
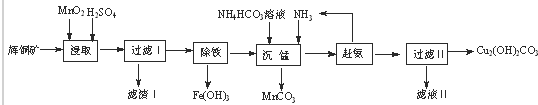


科目:高中化学 来源: 题型:
A、根据反应Cu+H2SO4
| ||||
| B、电解含Pb(NO3)2和Cu(NO3)2的溶液,阴极上阳离子得电子次顺依次是Cu2+、H+、Pb2+ | ||||
| C、含amolNa2S的溶液最多能吸收2.5amol的二氧化硫气体 | ||||
| D、因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3═2NaIO3+Cl2不能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
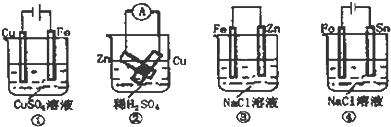
| A、按图①连接并放置一段时间后,Fe片表面会“镀”上一层铜 |
| B、按图②连接好导线后(Zn片与Cu片相接触),灵敏电流表会发生非常明显的偏转 |
| C、按图③连接并放置片刻,在Fe片附近加一滴KSCN溶液,溶液变为深红色 |
| D、按图④连接并放置一段时间后,在Sn片上有无色气泡聚集 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
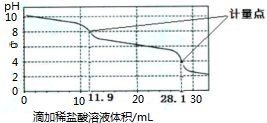
| A、上一个计量点前发生反应的离子方程式为HCO3-+H+═H2O+CO2↑ |
| B、下一个计量点溶液中存在大量的阴离子是Cl-、HCO3- |
| C、此样品n(NaHCO3)=(28.1-2×11.9)×10-3 mol |
| D、使用该方法测定Na2CO3和NaOH混合溶液中的氢氧化钠含量,将会得到1个计量点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
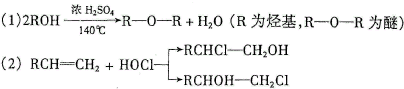

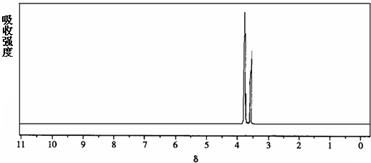
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
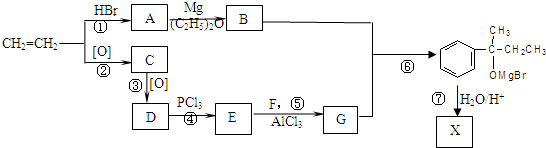
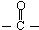 )的化合物反应生成醇,其过程可表示如下:
)的化合物反应生成醇,其过程可表示如下: (-R1、-R2表示烃基)
(-R1、-R2表示烃基)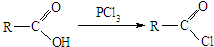
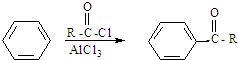
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学事实 | 推论 | |
| A | 将SO2通入品红溶液中,溶液褪色 | SO2具有氧化性 |
| B | 铝热反应需要高温引燃 | 该反应的△H>0 |
| C | 聚光束仪照射淀粉溶液,看到一条“光亮通路” | 淀粉分子直径>10-7m |
| D | 向溶液中滴加KSCN,无明显现象,再加氯水,看 到溶液变为血红色 | 说明原溶液中含有Fe2+ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com