
����Ŀ����������װ�����һ��ʵ�飬�ԲⶨSO2ת��ΪSO3��ת���ʣ�
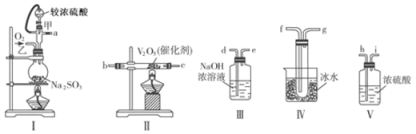
��1��д��I����70%�����������������ȡ��������Ļ�ѧ����ʽ ��
��2����Щװ�õ�����˳����������ҵķ�����a�� �� �� �� �� �� �� ��d������ӿڵı�ţ���
��3�����Ҵ�����ͨ��O2��ΪʹSO2�нϸߵ�ת���ʣ�ʵ��ʱ��������Ũ�������������ȴ������Ⱥ�˳���� ��II�з����Ļ�ѧ����ʽΪ ��
��4�������۲쵽�������� ��
��5���������ô�������ƿʱ��SO2��ת���ʻ� ���������������������������С����
���𰸡���1��Na2SO3+H2SO4(Ũ)=Na2SO4+SO2��+H2O����2��h��i��b��c��f��g��d��
��3���ȼ���V2O5��������Ũ���2SO2+O2![]() 2SO3��
2SO3��
��4���а�ɫ����(�����)���ɣ�
��5������
��������
�����������1���������ԣ� H2SO4 >H2SO3������70%��Ũ������Na2SO3�ᷢ�����ֽⷴӦ������SO2���壬��Ӧ�Ļ�ѧ����ʽ�ǣ�Na2SO3+H2SO4(Ũ)=Na2SO4+SO2��+H2O��
��2�������Һ�з�Ӧ���������л���ˮ���������Բ������������Ⱦ�������װ�â�Ȼ���ٽ��ж�����������Ĵ�����������װ�â�Ȼ�����ռ�SO3��SO3���۵���16.8�棬�е���44.8�棬����ѡ��װ�â�������ȴ��ʹ�������������������룬����ڢ�������δ��Ӧ��SO2��Ҫ�Ʊ����������������������ʡ��ռ��������������õ���װ��Ϊ�������巢��װ�ã�������װ�ã���Ϊ�������������װ�ã����ռ�װ�ã���β������װ�ã�������ȷ��˳��Ϊ��a h i b c fg d��
��3��Ϊ��֤�����Ķ��������ܶ��ת��Ϊ��������Ӧ�ȼ���V2O5��������Ũ���ᣬ����SO2��O2����������SO3��������Ӧ�Ļ�ѧ����ʽ��2SO2+O2![]() 2SO3��
2SO3��
��4��װ��IV����������ȴ�����������壬ʹ֮���Һ̬���̬���Ӷ��ռ��õ������������Կ����ڢ�����������ɫ�����ɫ�����壨����壩���ɣ�
��5�������ȣ����ɶ�������Ͽ죬���ܳ�ַ�Ӧ����SO2��ת���ʻ���С��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����25��ʱ��2mol�Ҵ���C2H5OH������������ȫȼ�շų�������Ϊ2733.6kJ��д����ʾ�Ҵ�ȼ���ȵ��Ȼ�ѧ����ʽ ��
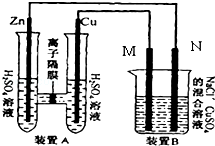
��2�������Ҵ���ȼ�շ�Ӧ�������������������Һ���һ��ȼ�ϵ�أ���ͨ��������һ��Ϊ �����������������������������ĵ缫��ӦʽΪ ��
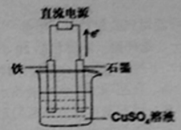
��3������ͼ��ʾװ���У�ʯī�缫�ĵ缫��ӦʽΪ �������ʼ�����CuSO4����������һ��ʱ�䣬����·��ת��1.0mol����ʱ��Ҫʹ��Һ�ָ���ԭŨ�ȣ��������м���������� ���ѧʽ����������Ϊ g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(��)�ڽ��з�Һ����ʵ��ʱ��Ҫ���õ��IJ����������ձ��� ���ڽ��з�Һʱ������Ҫ������� ��
(��)��ͼΪʵ������ȡ����ˮ��װ��ʾ��ͼ������ͼʾ�ش��������⡣

��1�� ͼ�����������ԵĴ����ǣ�
�� ��
�� ��
��2��A������������ ��B������������ ��
��3��ʵ��ʱA�г�������������ˮ�⣬����Ҫ���������� ���������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ϣʱ�������Ĵ������������Ի�����������в��ij�о���ѧϰС�齫һ����������·������õ���70%Cu��25%Al��4%Fe������Au��Pt�Ƚ����Ļ�������Ƴ������Ʊ�����ͭ�������������·�ߣ�
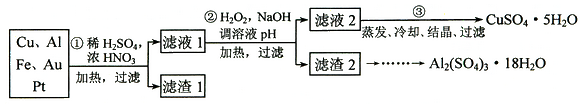
��1�� �ڢٲ�Cu���ᷴӦ�����ӷ���ʽΪ ��
��2�� �ڢڲ���H2O2�������� ��
��3�� ��̽��С��������ַ����ⶨCuSO4��5H2O����Ĵ��ȡ�
����һ��ȡa g��������ˮ���������KI���壬��ַ�Ӧ�����ɰ�ɫ��������0.100 0 mol��L��1Na2S2O3����Һ�ζ�(ԭ��ΪI2��2S2O![]() ===2I����S4O
===2I����S4O![]() )������ζ��յ�ʱ������Na2S2O3����Һ20.00 mL��
)������ζ��յ�ʱ������Na2S2O3����Һ20.00 mL��
�� �ζ������п�ѡ��________��ָʾ�����ζ��յ��������____________��
�� CuSO4��Һ��KI��Ӧ�����ӷ���ʽΪ ��
��������ȡa g�������100 mL��Һ��ÿ��ȡ20.00 mL�������������Ӻ���c mol��L��1EDTA(H2Y2��)��
��Һ�ζ����յ㣬ƽ������EDTA��Һ6 mL���ζ���Ӧ���£�Cu2����H2Y2��===CuY2����2H����
�� д������CuSO4��5H2O���������ı���ʽw��___________��
��4���벹������������2�Ʊ�Al2(SO4)3��18H2O��ʵ�鷽�����߽����������2������_________�����������ܽ��������� ����Һ�� �����ˡ���ˮϴ�ӹ���2-3�Σ���50���¸���õ�Al2(SO4)3��18H2O��(��ѡ�Լ��У�������Һ������������Һ����ˮ��������̼)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʵ�������������ƹ�������1.0 mol��L��1��NaOH��Һ250mL���ش��������⣺
��1��ʵ��������������ƽ��ҩ�ס��ձ�����������(��Ͳ)�� ��
��2��ʵ�鲽�裺�����㣺�����������ܽ⣬����Һ����ϴ�ӣ��� ��ҡ�ȡ����������Ȼ��Ƶ�����Ϊ g��
��3�����в���ʹ������Һ��Ũ��ƫ�����________��
A��������ƽ�����̷���ֽ����NaOH |
B��δϴ���ܽ�NaOH���ձ� |
C���ܽ��δ��ȴ������ת�Ƶ�����ƿ�� |
D������ʱ���ӿ̶��� |
E��ҡ�ȣ����ú���Һ�治���̶��ߣ��ټ�ˮ���̶���
F������ƿδ���T����������Һ
��4����ͼ��ʵ�鲽������ʾ��ͼ��ͼ�еĴ�����
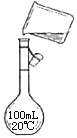
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Na2CO3������������ǶԴ�����ò�ͬ���෨�ķ��࣬����ȷ���ǣ� ��
A. Na2CO3�Ǽ� B. Na2CO3����
C. Na2CO3������ D. Na2CO3��̼����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)ijѧ��ʵ��С����50mL0.50molL��1��������50mL0.50molL��1��NaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��Ӧ�ȵIJⶨ
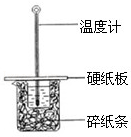
��ͼ��װ��ȱ�ٵ�һ������������������Ϊ ��
������Ӧ���Һ�� �¶ȼ�Ϊ��Ӧ����ֹ�¶ȣ�
������˵����ȷ���� ��
A��С�ձ��ڲ�����ˮ����ʹ��õķ�Ӧ����ֵƫС
B��������ͬŨ�Ⱥ�����Ĵ������ϡ������Һ����ʵ��
C���ձ���������ֽ���������ǹ̶�С�ձ�
D���ᡢ����ʱ��Ӧ����Ͳ�е���Һ���������ձ�����Һ�У��Է�Һ���⽦��
��2����ͼװ��B����Ũ�Ⱦ�Ϊ0.1mol/L��NaCl��CuSO4�����Һ����Һ���Ϊ500ml��M��N��Ϊʯī�缫����װ��A��Zn����������6.5gʱ��N���������� g����ʱ�����е缫���ܹ��ռ���������������Ϊ L������ɱ�״���µ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʽ̼������[NaaAlb(OH)c(CO3)d]��������ȼ����������ȡ�
���Ʊ������ǣ������¶ȡ�pH����NaHCO3ϡ��Һ�м���Al(OH)3�������裬��ַ�Ӧ����ˡ�ϴ�ӡ�����ü�ʽ̼��������
��1�� ��ʽ̼������[NaaAlb(OH)c(CO3)d]��a��b��c��d֮��Ĺ�ϵΪ____________��
��2�� ��ʽ̼��������Ϊ��ȼ���Ŀ���ԭ���ڷֽ�����д����������ڱ������������Ҳ���ȼ��
�� ��
��3�� ��pH���ߣ���Բ�Ʒ��Ӱ���� ��
��4�� Ϊȷ����ʽ̼����������ɣ���������ʵ�飺
��ȷ��ȡ2.880 g��Ʒ������ϡ�����ܽ⣬�õ�CO2 0.448 L(�ѻ���ɱ�״����)����������Һ���ӹ�����ˮ���õ���ɫ�����������ˡ�ϴ�ӳ�����������յõ�1.02g������
�ڼ�����340 ������ʱ��ƷѸ�ٷֽ⣬�õ����������CO2��H2O������Ʒ�ֽ���ȫʱ����Ʒ�Ĺ��������Ϊ56.9%����������ʵ������ȷ����ʽ̼�����������(д���������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰ��ȤС�������ø�����(����Ҫ�ɷ���Al2O3��2SiO2��2H2O)�Ʊ����͵ľ�ˮ����ʵ���������£�
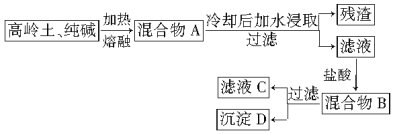
������ҺC�������Ʊ��ľ�ˮ����
������������⣺
(1)д�������A��B����ҺC������D����Ҫ�ɷ֣�
A________��B________��C________��D________��
(2)д���������봿��������ڵ�������ѧ����ʽ��________��________��
(3)��ʵ���У����ڸ�����������Ļ�������ѡ�õ�������________��
A���������� B��������
C������������ D��������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com