
分析 (1)依据m=cVM计算需要溶质的质量;依据c=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,依据溶液稀释过程中所含溶质的物质的量不变计算需要浓硫酸体积;
(2)依据配制一定物质的量浓度溶液的一般步骤选择合适的仪器;
(3)依据浓硫酸稀释的正确操作解答;
(4)分析不当操作对溶质的物质的量和溶液的体积的影响,依据c=$\frac{n}{V}$进行误差分析;
解答 解:(1)配制480mL0.2mol/L 的NaCl溶液,应选择500mL容量瓶,需要溶质的质量m=0.2mol/L×58.5g/mol×0.5L=5.9g;
98%的浓H2SO4(密度为1.84g/cm3)的物质的量浓度c=$\frac{1000×1.84×98%}{98}$=18.4mol/L,配制480mL0.2mol/L 的稀H2SO4,应选择500mL容量瓶,设需要浓硫酸体积为V,则依据溶液稀释过程中所含溶质的物质的量不变得:0.2mol/L×0.5L=18.4mol/L×V,解得V=0.0054L,即5.4mL;
故答案为:5.9;5.4;
(2)配制NaCl溶液的步骤是计算、称量、溶解、洗涤、定容、摇匀、装瓶,用到的仪器是:托盘天平、烧杯、玻璃棒、500ml容量瓶、胶头滴管;
配制稀H2SO4的步骤是计算、量取、稀释、洗涤、定容、摇匀、装瓶,用到的仪器是:量筒、烧杯、玻璃棒、500ml容量瓶、胶头滴管;
配制两种溶液时都需要仪器:烧杯、玻璃棒、500ml容量瓶、胶头滴管;
故答案为:烧杯、玻璃棒、500ml容量瓶、胶头滴管;
(3)由于浓硫酸密度大、溶于水放热,故稀释浓硫酸的方法:将浓硫酸沿烧杯内壁注入水中,边倒边用玻璃棒搅拌.
故答案为:将浓硫酸沿烧杯内壁注入水中,边倒边用玻璃棒搅拌;
(4)A、在烧杯中溶解溶质搅拌时,溅出少量溶液,导致溶质的物质的量偏低,溶液浓度偏低,故A选;
B、没有用蒸馏水洗烧杯2~3次,并将洗液移入容量瓶中,导致溶质的物质的量偏低,溶液浓度偏低,故B选;
C、定容时,加水超过了刻度线,倒出一些再重新加水到刻度线,导致溶质的物质的量偏低,溶液浓度偏低,故C选;
D、将所配溶液从容量瓶转移到试剂瓶时,有少量溅出,溶液浓度不变,故D不选;
E、把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用,溶液稀释,溶液浓度降低,故E选;
F、容量瓶刚用蒸馏水洗净,没有烘干,对溶质的物质的量和溶液的体积都不产生影响,溶液浓度不变,故F不选;
G、量筒量取浓H2SO4后没有用蒸馏水洗涤2~3次,并将洗液移入容量瓶中,量取的浓硫酸物质的量偏大,溶液浓度偏高,故G不选;
H、容量瓶加水定容时俯视刻度线,导致溶液的体积偏低,溶液浓度偏高,故H不选;
故选:ABCE;
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算、仪器选择和操作排序,属于基础型题目,明确原理是解题关键,难度不大.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:解答题
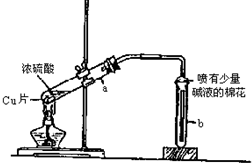 如图为浓硫酸与铜反应的实验装置图.
如图为浓硫酸与铜反应的实验装置图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  分离FeCl3溶液和蔗糖溶液 | B. |  称量8.55g氯化钠固体 | ||
| C. | 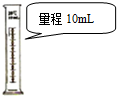 量取9.50 mL水 | D. | 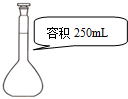 配制240 mL 0.1mol/L的NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
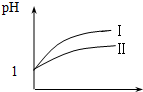 已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0.
已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用聚氯乙烯塑料袋包装食品 | |
| B. | 糖类、蛋白质、油脂属于天然高分子化合物 | |
| C. | 维生素C具有还原性,在人体内起抗氧化作用 | |
| D. | 煤经气化和液化两个物理变化过程,可变为清洁能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 5:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
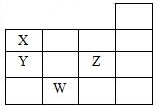 如图表示元素周期表的一部分,关于元素X、Y、Z、W的叙述正确的是( )
如图表示元素周期表的一部分,关于元素X、Y、Z、W的叙述正确的是( )| A. | 只有③ | B. | 只有①③ | C. | 只有①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH、KOH、CsOH碱性依次增强 | |
| B. | Li、Na、K、Rb、Cs的失电子能力逐渐增强 | |
| C. | Al3+、Mg2+、Na+的离子半径依次减小 | |
| D. | O22-和S2-具有相同的质子数和电子数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com