
| KMnO4(H+) |
| kmNo4(H+) |
| 催化剂 |
| 催化剂 |
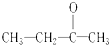 ,依据烯烃与高锰酸钾酸性溶液反应的氧化产物的规律可知该烯烃的结构简式为:CH2=C(CH3)C2H5,
,依据烯烃与高锰酸钾酸性溶液反应的氧化产物的规律可知该烯烃的结构简式为:CH2=C(CH3)C2H5,

科目:高中化学 来源: 题型:
| A、①②④ | B、⑤⑥ |
| C、③⑤ | D、②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
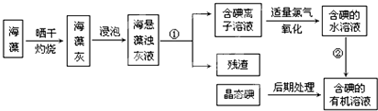
| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液. | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡. | 溶液无变化 |
| 然后再滴入1滴1mol/L的H2SO4,振荡. | 溶液变蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
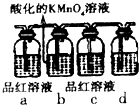 掌握物质之间的转化,是学习元素化合物知识的基础.
掌握物质之间的转化,是学习元素化合物知识的基础.查看答案和解析>>
科目:高中化学 来源: 题型:
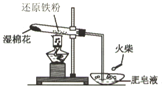 为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验.
为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验.| HCl |
| 足量Fe粉 |
| NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
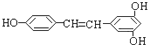 )广泛存在于食物(如桑葚、花生、葡萄)中,它可能具有抗癌性.能够跟1mol该化合物起反应的Br2或H2的最大用量分别是( )
)广泛存在于食物(如桑葚、花生、葡萄)中,它可能具有抗癌性.能够跟1mol该化合物起反应的Br2或H2的最大用量分别是( )| A、1mol,1mol |
| B、3.5mol,7mol |
| C、5mol,7mol |
| D、6mol,7mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3、NaHCO3两种盐溶液中,离子种类不相同 |
| B、常温下,1mol/L的CH3COOH溶液与1mol/L的NaOH溶液等体积混合,所得混合液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C、物质的量浓度相同的NH4Cl和NH4HSO4两种溶液中,c(NH4+)前者小于后者 |
| D、常温下,某溶液中有水电离出的c(H+)=10-51mol?L-1,则此溶液可能是盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室利用Na2SO3与硫酸制取SO2气体时,一般采用浓度较大的硫酸 |
| B、向白纸上滴几滴浓硫酸 |
| C、向浓硫酸中滴加浓盐酸制取HCl气体 |
| D、利用金属Cu与浓硫酸反应制取SO2气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com