
下列实验能达到预期目的的是( )
①用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸;②用NaOH溶液除去苯中的少量苯酚;③用饱和NaHCO3溶液除去CO2中的少量SO2;④用加热的方法提取NH4Cl固体中混有的少量碘;⑤用酒精萃取碘水中的碘。
A.①⑤ B.①②④⑤ C.②③ D.②③⑤
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源:2015-2016学年海南省高二上12月段考化学试卷(解析版) 题型:选择题
某温度时,在密闭容器中,X、Y、Z三种气体浓度的变化如图Ⅰ所示,若其它条件不变,当温度分别为T1和T2时,Y的体积分数与时间关系如图Ⅱ所示。则下列结论正确的是
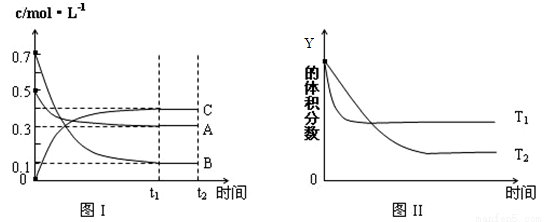
A.该反应的热化学方程式为:X(g)+3Y(g) 2Z(g);△H<0
2Z(g);△H<0
B.若其它条件不变,升高温度,正、逆反应速率均增大,X的转化率增大
C.达到平衡后,若其他条件不变,减小体积,平衡向逆反应方向移动
D.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古赤峰二中高一上第二次月考化学试卷(解析版) 题型:选择题
在标准状况下,m g气体A与n g气体B的分子数相同,下列说法中不正确的是( )
A.两种气体A与B的相对分子质量之比为m∶n
B.同质量气体A与B的分子数之比为n∶m
C.同温同压下,A与B两气体的密度之比为n∶m
D.相同状况下,同体积A与B两气体的质量之比为m∶n
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二上12月月考化学试卷(解析版) 题型:填空题
现有25℃时0.1mol•L-1的氨水,请回答下列问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中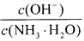 ______(填“增大”“减小”“不变”).
______(填“增大”“减小”“不变”).
(2)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式______;所得溶液的pH_____(填“>”、“<”或“=”),用离子方程式表示其原因______;
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol•L-1,则c(SO42-)=______;
(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中各离子的物质的量浓度由大到小的顺是______;
查看答案和解析>>
科目:高中化学 来源:2015-2016学年西藏山南第二高级中学高一上期末化学试卷(解析版) 题型:选择题
奶粉行业的“911事件”将三聚氰胺引入公众视野,工业上可用尿素为原料,在一定条件下合成三聚氰胺:6CO(NH2)2→6NH3+3CO2+C3H6N6,对C3H6N6说法正确的是
A.摩尔质量为126
B.式量为126g•mol-1
C.每个C3H6N6分子含3个N2分子
D.0.1 mol C3H6N6含碳原子数为1.806×1023
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高二上期中测试化学试卷(解析版) 题型:选择题
下列关于有机物的叙述正确的是
A.乙醇不能发生取代反应 B.C4H10有三种同分异构体
C.淀粉和纤维素互为同分异构体 D.乙烯和甲烷可用溴的四氯化碳溶液鉴别
查看答案和解析>>
科目:高中化学 来源:2016届贵州市高三上学期第五次月考理综化学试卷(解析版) 题型:填空题
短周期元素A、B、C、D、E,A为原子半径最小的元素,A、D同主族,D、E同周期,CE同主族且E的原子序数为C的原子序数的2倍,B为组成物质种类最多的元素。
(1)E离子的原子结构示意图__________________;
(2)分别由A、C、D、E四种元素组成的两种盐可相互反应得到气体,写出这个反应的离子方程式__________________;
(3)由A、B、C三种元素组成的物质X,式量为46,在一定条件下与C、D两种元素的单质均可反应.写出X与C单质在红热的铜丝存在时反应的化学方程式__________________;
(4)A、C、D三种元素组成的化合物Y中含有的化学键为_______________,B的最高价氧化物与等物质的量的Y溶液反应后,溶液显________(“酸”、“碱”或“中”)性,原因是________________;
(5)A的气体单质和C的气体单质可发生反应,在“神舟六号”飞船上使用了根据这反应设计的燃料电池,电解质溶液为KOH溶液,电池负极反应为__________,使用这种电池的优点为_____________;
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三上学期第五次月考化学试卷(解析版) 题型:选择题
对于反应aX(g)+bY(g) cZ(g)+dR(g) △H=QkJ/mol反应开始时,容器内充入X、Y或Z、R如图所示表示反应达到平衡后,图1、图2分别表示反应达到平衡后,改变温度和压强对反应的影响,下列叙述中正确的是
cZ(g)+dR(g) △H=QkJ/mol反应开始时,容器内充入X、Y或Z、R如图所示表示反应达到平衡后,图1、图2分别表示反应达到平衡后,改变温度和压强对反应的影响,下列叙述中正确的是
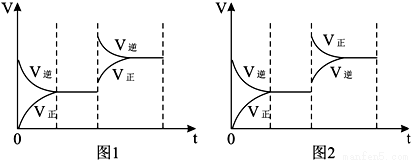
A.开始时充入X和Y a+b>c+d Q<0
B.开始时充入X和Y a+b>c+d Q>0
C.开始时充入Z和R a+b>c+d Q<0
D.开始时充入Z和R a+b<c+d Q>0
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东汕头金山中学高二上12月月考化学卷(解析版) 题型:填空题
I.常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:

(1)写出MOH的电离方程式:__________________
(2)MOH与HA恰好完全反应时,溶液呈________性(填“酸”、“碱”或“中”),理由是(用离子方程式表示):________________________________________________。
(3)D点时,溶液中c(A﹣)+c(HA)__________2c(M+)(填“>”、“<”或“=”).
II.室温下,几种物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuI |
Ksp | 2.2×10-20 | 2.6×10-39 | 1.3×10-12 |
(1)室温下,某酸性CuCl2溶液中含少量的FeCl3,为得纯净CuCl2溶液,宜加入__________调至溶液pH=4,使Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=__________________
(2)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(杂质不与I―发生氧化还原反应)的纯度,过程如下:取试样溶于水,加入过量KI固体,充分反应,有白色沉淀(CuI)产生。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液V mL。(已知:I2+2S2O32- S4O62-+2I―。)
S4O62-+2I―。)
①CuCl2溶液与KI反应的离子方程式为______________________________。
②可选用________作滴定指示剂,滴定终点的现象是:滴入最后一滴Na2S2O3,________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com