
【题目】一定质量的镁、铝混合物投到2 mol·L-1的盐酸中,待金属完全溶解后,向溶液中加入2 mol·L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示。则:
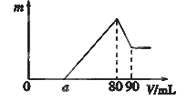
(1)80-90ml对应反应的离子方程式_____________;
(2)金属铝的质量为____________g;
(3)盐酸的体积是____________mL;
(4)a的取值范围是________________。
【答案】Al(OH)3+ OH-=AlO2-+2H2O 0.54g 80mL 0<a<50
【解析】
0~a段没有生成沉淀,说明盐酸过量,加入的氢氧化钠与氯化氢反应;a~80段开始生成沉淀,加入80mL氢氧化钠溶液后沉淀达到最大量,此时溶液中的溶质为NaCl;80~90段氢氧化铝开始溶解,溶解氢氧化铝消耗了10mLNaOH,则氢氧化铝沉淀的物质的量为:2mol/L×0.01L=0.02mol;当加入90mLNaOH溶液后氢氧化铝完全溶解,此时沉淀只有氢氧化镁,
(1)80~90ml为氢氧化铝与氢氧化钠反应生成偏铝酸钠和水;
(2)氢氧化钠的体积在80至90mL段内,所有的氢氧化钠用于溶解氢氧化铝,根据氢氧化钠的量确定氢氧化铝的量,根据原子守恒确定金属铝的量;
(3)加入80mL氢氧化钠溶液时,溶质为NaCl,根据质量守恒可以计算出氯化氢的物质的量,再根据V=![]() 计算出盐酸的体积;
计算出盐酸的体积;
(4)合金的组成可以采用极限假设法,当金属全部是金属铝时剩余的酸最多,a的值最大来判断a得取值范围。
(1)根据图可知,首先发生的反应是中和过量的酸:H++OH-=H2O,然后是沉淀两种金属离子:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,最后是Al(OH)3的溶解:Al(OH)3+ OH-=AlO2-+2H2O,即80~90ml对应反应的离子方程式为Al(OH)3+ OH-=AlO2-+2H2O;
(2)从横坐标80mL到90mL这段可以求出n(Al(OH)3)=n(OH-)=2 mol·L-1×0.01L=0.02mol,则n(Al)=n(Al(OH)3)=0.02mol,即为0.54g;
(3)镁、铝混合物投到盐酸中,生成氯化镁和氯化铝,并且从图上可知盐酸过量,当加入氢氧化钠溶液后,氢氧化钠先与过量的酸反应生成氯化钠,后氢氧化钠又与氯化镁和氯化铝反应生成氯化钠,当氢氧化钠溶液的体积为80mL时,盐酸中的氯离子都与钠离子结合成氯化钠,根据原子守恒可知,n(HCl)=n(NaOH)=2 mol·L-1×0.08L=0.16mol,则盐酸的体积为V=![]() =0.16mol÷2mol/L=0.08L=80mL;
=0.16mol÷2mol/L=0.08L=80mL;
(4)假设盐酸溶解金属后不剩,这种情况下,酸恰好与合金反应完全,即a=,通过极值法,当合金中完全是铝时,因为沉淀Al3+需要NaOH溶液的体积为30mL,从图可知,中和过量的酸所消耗的碱液体积最大为50mL,但是假设不成立,最大值是不存在的,所以的取值范围为0<a<50。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
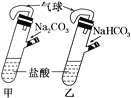
A.分别在甲乙两支侧管中装入1.06gNa2CO3和0.84gNaHCO3,试管中各有10mL相同浓度的盐酸(如图)同时将两个侧管中的物质全部倒入各自的试管中,乙装置的气球膨胀速率大
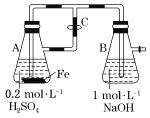
B.用如图装置可以制备沉淀Fe(OH)2
C.取少量Fe(NO3)2试样加水溶解,加稀H2SO4酸化,滴加KSCN溶液,溶液变为红色。结论:该Fe(NO3)2试样已经变质
D.Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液充分反应,过滤,向滤液中通入过量CO2后过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,向20 mL 0.1 mol·L1 MOH溶液中滴加0.1 mol·L1 CH3COOH溶液, 所得溶液的pH(对应曲线M)及导电能力(对应曲线N)变化如图所示。下列叙述正确的是
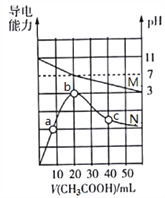
A. MOH是弱碱,其Kb=1.0×1021
B. b点溶液中,c(CH3COO)+ c(CH3COOH)=0.1 mol·L1
C. 水的离子积常数Kw:b>c>a
D. c点溶液中,c(CH3COO)>c(M+)>c(H+)>c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往 100 g FeCl3 和 CuCl2 的混合溶液中加入铁粉。已知 FeCl3会先与铁粉发生反应:2FeCl3 + Fe =3FeCl2。下图为加入铁粉的质量与反应后剩余固体质量关系。下列说法不正确的是

A.D 点对应纵坐标为 6.4
B.B 点后溶液的颜色为蓝色
C.该 100 g 溶液中的 CuCl2质量分数为 13.5%
D.取 DE 两点间(不含 D)的剩余固体加入盐酸,均有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 2.1g丙烯中所含的共用电子对总数为0.3NA
B. 4.6gNO2和N2O4的混合气体中含有的氮原子数为0.1NA
C. 过氧化氢分解制得标准状况下2.24LO2,转移电子数目为0.4NA
D. 在高温高压、催化剂的条件下,56gN2和12gH2充分反应,生成NH3的分子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处于平衡状态的反应:2H2S(g)![]() 2H2(g)+S2(g) ΔH>0,不改变其他条件的情况下,下列叙述正确的是( )
2H2(g)+S2(g) ΔH>0,不改变其他条件的情况下,下列叙述正确的是( )
A.加入催化剂,反应途径将发生改变,ΔH也将随之改变
B.升高温度,正、逆反应速率都增大,H2S分解率也增大
C.增大压强,平衡向逆反应方向移动,将引起体系温度降低
D.若体系恒容,注入一些H2后达新平衡,H2的浓度将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备 Fe(OH)2,装置如右图所示,其中电解池两极材料分别为铁和石墨,通电一段时间后,右侧玻璃管中产生大量的白色沉淀。则下列说法正确的是
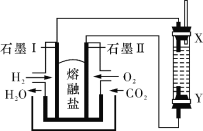
A. 石墨电极Ⅱ处的电极反应式为O2+4e-=2O2-
B. X是铁电极
C. 电解池中有1mol Fe溶解,石墨Ⅰ耗H2 22.4 L
D. 若将电池两极所通气体互换,X、Y两极材料也互换, 实验方案更合理。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲为恒温、恒压容器,乙为恒温、恒容容器。两容器中均充入1 mol N2、3 mol H2,初始时两容器的温度、体积相同。一段时间后反应达到平衡,为使两容器中的N2在平衡混合物中的物质的量分数相同,下列措施中可行的是 ( )
A.向甲容器中充入一定量的氦气
B.向乙容器中充入一定量的N2
C.升高乙容器的温度
D.增大甲容器的压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水中存在大量的Na+、Cl-、Cu2+、SO42-,欲除去其中的Cu2+、SO42-,设计工艺流程如图所示:

下列说法不正确的是
A.NaOH的作用是除去Cu2+B.试剂a 为Na2CO3,试剂b为BaCl2
C.流程图中,操作x为过滤D.试剂c为盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com