
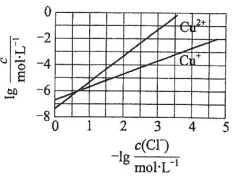
 在湿法炼锌的电解循环溶液中,较高浓度的Cl-会腐蚀阳极板而增大电解能耗.可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl-.根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是( )
在湿法炼锌的电解循环溶液中,较高浓度的Cl-会腐蚀阳极板而增大电解能耗.可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl-.根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是( )| A. | Ksp(CuCl)的数量级为10-7 | |
| B. | 除Cl-反应为Cu+Cu2++2Cl-=2CuCl | |
| C. | 加入Cu越多,Cu+浓度越高,除Cl-效果越好 | |
| D. | 2Cu+=Cu2++Cu平衡常数很大,反应趋于完全 |
分析 A.根据Ksp(CuCl)=c(Cu+)×c(Cl-)判断;
B.涉及反应物为铜、硫酸铜以及氯离子,生成物为CuCl;
C.铜为固体,加入铜的量的多少不能影响化学反应速率和效率;
D.酸性条件下,Cu+不稳定,易发生2Cu+=Cu2++Cu.
解答 解:A.由图象可知,横坐标为1时,lgc(Cu+)大于6,则Ksp(CuCl)的数量级为10-7,故A正确;
B.涉及反应物为铜、硫酸铜以及氯离子,生成物为CuCl,反应的方程式为Cu+Cu2++2Cl-=2CuCl,故B正确;
C.发生Cu+Cu2++2Cl-=2CuCl,反应的效果取决于Cu2+的浓度,如Cu2+不足,则加入再多的Cu也不能改变效果,故C错误;
D.酸性条件下,Cu+不稳定,易发生2Cu+=Cu2++Cu,可知没有Cl-存在的情况下,2Cu+=Cu2++Cu趋向于完全,说明2Cu+=Cu2++Cu的平衡常数很大,故D正确.
故选C.
点评 本题综合考查含铜化合物的性质与应用,侧重考查学生的分析能力和计算能力,注意题给信息以及图标的分析,把握溶度积的计算,难度不大


科目:高中化学 来源: 题型:选择题
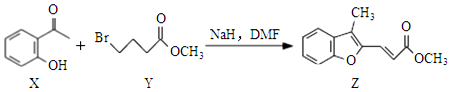
| A. | 物质X的分子中存在2种含氧官能团 | |
| B. | 物质Y可以发生水解和消去反应 | |
| C. | 1molZ最多可与2molBr2发生加成反应 | |
| D. | 等物质的量的X、Y分别与NaOH溶液反应,最多消耗的NaOH的物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某实验小组设计如下流程,模拟将汽车尾气中的氮氧化物(主要为NO和NO2的混合物)转化为工业用盐亚硝酸钠(NaNO2),并对亚硝酸钠进行多角度探究:汽车尾气$→_{操作①}^{20%NaOH}$溶液$\stackrel{操作②}{→}$固体$→_{③}^{操作}$NaNO2
某实验小组设计如下流程,模拟将汽车尾气中的氮氧化物(主要为NO和NO2的混合物)转化为工业用盐亚硝酸钠(NaNO2),并对亚硝酸钠进行多角度探究:汽车尾气$→_{操作①}^{20%NaOH}$溶液$\stackrel{操作②}{→}$固体$→_{③}^{操作}$NaNO2
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
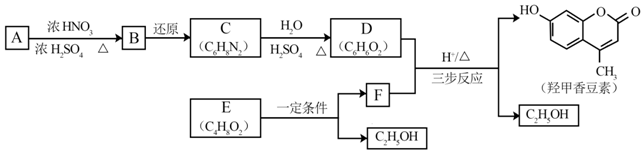
 .B中所含的官能团是硝基.
.B中所含的官能团是硝基. 和
和 .
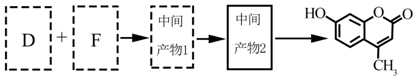
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
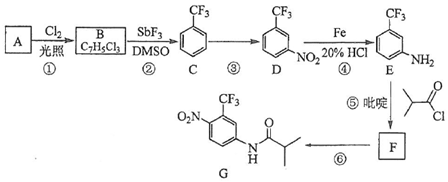
 .C的化学名称是三氟甲苯.
.C的化学名称是三氟甲苯.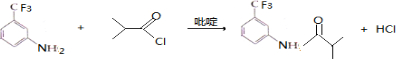 .吡啶是一种有机碱,其作用是吸收反应产生的氯化氢,提高反应转化率.
.吡啶是一种有机碱,其作用是吸收反应产生的氯化氢,提高反应转化率.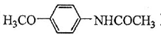 )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(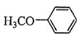 )制备4-甲氧基乙酰苯胺的合成路线
)制备4-甲氧基乙酰苯胺的合成路线 (其他试剂任选).
(其他试剂任选).查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 .B→C的反应条件为加热(或煅烧),C→Al的制备方法称为电解法.
.B→C的反应条件为加热(或煅烧),C→Al的制备方法称为电解法.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 1 | 2 | 3 |
| 消耗NH4SCN标准溶液体积/mL | 10.24 | 10.02 | 9.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器编号 | 物质的起始浓度(mol•L-1) | 物质的平衡浓度(mol•L-1) | ||
| c(NO2) | c(NO) | c(O2) | c(O2) | |
| Ⅰ | 0.6 | 0 | 0 | 0.2 |
| Ⅱ | 0.3 | 0.5 | 0.2 | |
| Ⅲ | 0 | 0.5 | 0.35 | |
| A. | 达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为 4:5 | |
| B. | 达平衡时,容器Ⅱ中 c(O2 )/c(NO2 ) 比容器Ⅰ中的大 | |
| C. | 达平衡时,容器Ⅲ中 NO 的体积分数小于50% | |
| D. | 当温度改变为 T2时,若 k正=k逆,则 T2>T1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com