
| A. | 苯是无色无味的液态径,不易燃烧 | |
| B. | 苯与浓硝酸、浓硫酸混合共热可制取硝基苯 | |
| C. | 溴水能与苯发生加成反应而褪色 | |
| D. | 在一定条件下苯与氢气反应制取环己烷,说明苯分子结构中有碳碳双键 |
分析 A.苯属于芳香烃,烃易燃烧生成二氧化碳和水;
B.苯与浓硝酸浓硫酸混合共热制取硝基苯,苯环上的H被硝基取代;
C.苯与溴水不反应,与液溴在铁做催化剂条件下反应生成溴苯;
D.在一定条件下苯与氢气发生加成反应制取环己烷,但苯分子结构中没有碳碳双键.
解答 解:A.苯是一种无色、有芳香气味的液体,易燃烧生成二氧化碳和水,故A错误;
B.苯与浓硝酸在浓硫酸、加入条件下发生取代反应生成硝基苯与水,反应方程式为 ,故B正确;
,故B正确;
C.苯与溴水不反应,与液溴在铁做催化剂条件下反应生成溴苯,溴水能与苯作用褪色,是苯萃取溴水中的溴,不是发生化学变化,故C错误;
D.苯分子中碳碳键是介于碳碳单键与双键之间的一种独特的化学键,苯与氢气在一定条件下反应生成环己烷,苯分子中不含有碳碳双键,故D错误;
故选B.
点评 本题考查了常见有机物的性质,熟悉苯的物理、化学性质是解题关键,注意苯分子结构特点,碳碳键是介于单键与双键之间独特的化学键,题目难度不大.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案科目:高中化学 来源: 题型:解答题
 ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液质量减轻 | |
| B. | Fe3+的氧化性大于Cu2+ | |
| C. | 溶液中Cu2+与Fe2+的物质的量比为1:1 | |
| D. | 1 mol Fe可还原2 mol Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;1mol O22+中含有的π键数目为2NA.
;1mol O22+中含有的π键数目为2NA.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池是将电能转化为化学能的装置 | |
| B. | 原电池中发生氧化反应的是负极 | |
| C. | 电解池是将化学能转化为电能的装置 | |
| D. | 电解池中发生氧化反应的是阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 甲 | 乙 | 丙 |
| 柚子 | 黄瓜 | 脐橙 |
| HOCH2COOH | C3H4O5 | 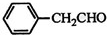 |
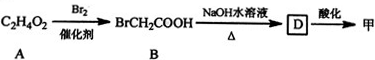
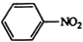 $\stackrel{Fe,HCl}{→}$
$\stackrel{Fe,HCl}{→}$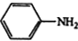 $→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$
$→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$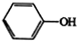
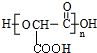 +(n-1)H2O.
+(n-1)H2O.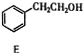 $\stackrel{经两步}{→}$
$\stackrel{经两步}{→}$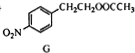 $→_{(2)H+,△}^{(1)Fe,HCl}$$\stackrel{{C}_{8}{H}_{11}NO}{H}$$→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$J
$→_{(2)H+,△}^{(1)Fe,HCl}$$\stackrel{{C}_{8}{H}_{11}NO}{H}$$→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$J查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
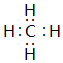
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com