
【题目】某研究性学习小组为了制取氨气和探究氨气的有关性质,进行了下列实验. 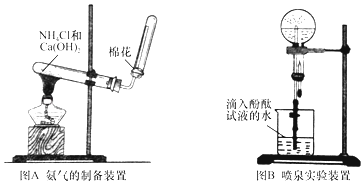
(1)根据图A写出实验室制取氨气的化学方程式;
(2)收集氨时,试管口棉花的作用;验满的方法是;收集干燥的氨时,使用的干燥剂是;
(3)实验室制取下列气体时,与实验室制取氨气的气体发生装置相同的是 .
A.氢气
B.氧气
C.氯气
D.二氧化碳
(4)图B装置进行喷泉实验,烧瓶中充满氨气,引发水上喷的操作是;所得溶液呈性(填酸性、碱性或中性),解释原因(用化学方程式表示) .
【答案】
(1)2NH4Cl+Ca(OH) ![]() 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O
(2)防止与空气对流收集不到纯净的氨气;将湿润的红色石蕊试纸靠近试管口,看试纸是否变蓝(或用蘸有浓盐酸的玻璃棒放在瓶口,产生白烟);碱石灰
(3)B
(4)打开止水夹,挤出胶头滴管中的水;碱; NH3+H2O?NH3?H2O?NH4++OH﹣
【解析】解:(1)氨盐和碱反应生成氨气和水,实验室用氢氧化钙和氯化铵在加热条件下反应制备氨气,反应的化学方程式为:Ca(OH)2+2NH4Cl ![]() CaCl2+2NH3↑+2H2O,
CaCl2+2NH3↑+2H2O,
所以答案是:2NH4Cl+Ca(OH) ![]() 2NH3↑+CaCl2+2H2O;(2)氨气极易溶于水,所以不能采用排水法收集氨气,氨气的密度小于空气且常温下和氧气不反应,根据图象知,氨气采用向下排空气法收集;氨气有刺激性气味,能污染大气,为防止管内气体与空气对流,减少氨气对大气的污染,便于收集纯的氨气,用棉花塞在试管口,检验氨气是否集满,可以利用氨气的水溶液显碱性,即用“使湿润的红色石蕊试纸变蓝”;也可以用氨气遇浓盐酸产生白烟,即“用蘸有浓盐酸的玻璃棒放在瓶口,产生白烟”,碱石灰是固体氢氧化钠和氧化钙的混合物,氨气不能与碱石灰反应,且碱石灰能吸水,所以用碱石灰作干燥剂,
2NH3↑+CaCl2+2H2O;(2)氨气极易溶于水,所以不能采用排水法收集氨气,氨气的密度小于空气且常温下和氧气不反应,根据图象知,氨气采用向下排空气法收集;氨气有刺激性气味,能污染大气,为防止管内气体与空气对流,减少氨气对大气的污染,便于收集纯的氨气,用棉花塞在试管口,检验氨气是否集满,可以利用氨气的水溶液显碱性,即用“使湿润的红色石蕊试纸变蓝”;也可以用氨气遇浓盐酸产生白烟,即“用蘸有浓盐酸的玻璃棒放在瓶口,产生白烟”,碱石灰是固体氢氧化钠和氧化钙的混合物,氨气不能与碱石灰反应,且碱石灰能吸水,所以用碱石灰作干燥剂,
所以答案是:防止与空气对流收集不到纯净的氨气;将湿润的红色石蕊试纸靠近试管口,看试纸是否变蓝(或用蘸有浓盐酸的玻璃棒放在瓶口,产生白烟);碱石灰;(3)实验室制取氨气,用的是固体与固体反应,需要加热,应该使用硬质大试管作反应器.
A、实验室制取氢气,是用锌与稀硫酸反应,不需要加热,可用试管、启普发生器等作为反应器,故A不选;
B、实验室制取氧气,可以用加热氯酸钾或高锰酸钾的方法,要使用加热固体反应物的装置,使用硬质大试管作反应器,故B选;
C、实验室制取氯气用浓盐酸与二氧化锰固体反应,需要加热,使用烧瓶作反应器,故C不选;
D、实验室制取二氧化碳,用的是碳酸钙与稀盐酸反应,不需要加热,可以使用试管作反应器,也可使用启普发生器,故D不选;
综合以上分析,实验室制取氧气和氨气的实验装置相同.
所以答案是:B;(4)氨气极易溶于水,如果打开止水夹,氨气溶于水后烧瓶内压强迅速减小,而形成喷泉,氨气和水反应生成一水合氨,反应为:NH3+H2ONH3H2O,一水合氨是弱电解质,在水溶液中部分电离生成铵根离子和氢氧根离子,电离方程式为NH3H2ONH4++OH﹣,溶液呈碱性,
所以答案是:打开止水夹,挤出胶头滴管中的水;碱;NH3+H2ONH3H2ONH4++OH﹣.


科目:高中化学 来源: 题型:
【题目】某元素X气态氢化物与该元素最高价氧化物的水化物反应生成盐,则该元素( )
A. 在周期表中处于第三周期ⅦA族 B. 在周期表中处于第二周期ⅤA族
C. 氢化物比H2O稳定 D. 常见化合价只有-3、+2、+3、+5价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.电镀时,通常把待镀的金属制品作阳极
B.氯碱工业是电解熔融的NaCl,在阳极能得到Cl2
C.氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为O2+4H++4e-=2H2O
D.工业冶炼金属铝的方法是电解熔融的氯化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以等物质的量混合的NaHCO3和KHCO3的混合物a g与100 mL盐酸反应.(题中涉及的气体体积以标准状况计,填空时可以用带字母的数学式表示,不必化简)
(1)该混合物中NaHCO3和KHCO3的质量比为 .
(2)如果反应后盐酸不足量,要计算生成CO2的体积,还需知道 , 理由是 .
(3)若该混合物与盐酸恰好完全反应,则盐酸的物质的量浓度为
(4)若NaHCO3和KHCO3不是以等物质的量混合,则a g固体混合物与足量的盐酸完全反应时,生成CO2的体积(V)的取值范围是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列由事实得出的结论错误的是( )
A.维勒用无机物合成了尿素,突破了无机物与有机物的界限
B.门捷列夫在前人工作的基础上发现了元素周期律,表明科学研究既要继承又要创新
C.C60是英国和美国化学家共同发现的,体现了国际科技合作的重要性
D.科恩和波普尔因理论化学方面的贡献获诺贝尔化学奖,意味着化学已成为以理论研究为主的学科
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.氯化铝溶液中加入过量氨水反应的实质是Al3++3NH3?H2O═Al(OH)3↓+3NH ![]()
B.存在于污水中的重金属离子,常用投加明矾等电解质的方法进行处理
C.镁铝合金既可完全溶于过量盐酸又可完全溶于过量NaOH溶液
D.依据铝热反应原理,能发生反应2Al+3MgO ![]() 3Mg+Al2O3
3Mg+Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图中,甲烧杯中盛有100mL 0.50molL﹣1 AgNO3溶液,乙烧杯中盛有100mL 0.25molL﹣1CuCl2溶液,A,B,C,D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.9g,则 
(1)电源E为极,F为极.
(2)A极的电极反应式为 , 析出物质mol.
(3)B极的电极反应式为 , 析出气体mL(标).
(4)C极的电极反应式为 , 析出的物质mol.
(5)D极的电极反应式为 , 析出气体mL(标况).
(6)甲烧杯中滴入石蕊试液,极附近变红,若继续电离,在甲烧杯中最终得到溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p轨道有3个未成对电子;C的基态原子2p轨道有1个未成对电子;E原子最外层有1个未成对电子,其次外层有3种原子轨道且均排满电子,;D与E同周期,价电子数为2.则:
(1)写出基态E原子的电子排布式 .
(2)1mol A的单质分子中π键的个数为 .
(3)A、B、C 三种元素的氢化物稳定性由强到弱的顺序为(用化学式表示).
(4)A的简单氢化物分子的空间构型为 , 其中A原子的杂化类型是 .
(5)C和D形成的化合物的晶胞结构如图,已知晶胞边长a cm,阿伏加德罗常数为NA , 求晶体的密度为ρ=g/cm3 . (用含a、NA的计算式表示) 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3 , 含Fe2O3杂质)为原料冶炼铝的工艺流程如下,下列叙述正确的是( ) 
A.试剂X可以是氢氧化钠溶液,也可以是盐酸
B.反应①、过滤后所得沉淀为氢氧化铁
C.图中所示转化反应都不是氧化还原反应
D.反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com