
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是( )
A.若X+和Y2-的核外电子层结构相同,则原子序数:X>Y
B.由水溶液的酸性:HCl>H2S,可推断元素的非金属性:Cl>S
C.硅、锗都位于金属与非金属的交界处,都可以作半导体材料
D.Cs和Ba分别位于第六周期ⅠA和ⅡA族,则碱性:CsOH>Ba(OH)2
科目:高中化学 来源: 题型:
已知A、B、C为中学化学中常见单质。室温下,A为固体,B和C均为气体。在适宜的条件下,它们有如图所示的转化关系。
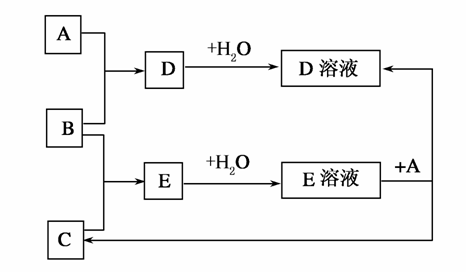
回答下列问题。
(1)A、B、C三种单质的组成元素中的任意两种形成的化合物所属物质类别一定不是________。
①氢化物 ②酸 ③碱 ④盐 ⑤氧化物
理由是_________________________________________。
(2)A、B、C三种元素中有一种是金属,则三种元素中可能是金属的是________,理由是_________________________________。
(3)如果E溶液是一种强酸,写出E作为还原剂参加反应的离子方程式:______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
1,3-丁二烯和2-丁炔分别与氢气反应的热化学方程式如下:
CH2=CH—CH=CH2(g) + 2H2(g) → CH3CH2CH2CH3(g) + 236.6 kJ
CH3-C≡C-CH3(g) + 2H2(g) → CH3CH2CH2CH3(g) + 272.7 kJ
由此不能判断
A.1,3-丁二烯和2-丁炔稳定性的相对大小
B.1,3-丁二烯和2-丁炔分子储存能量的相对高低
C.1,3-丁二烯和2-丁炔相互转化的热效应
D.一个碳碳叁键的键能与两个碳碳双键键能之和的大小
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2Zn(s)+O2(g)===2ZnO(s) ΔH=-701.0 kJ·mol-1 2Hg(l)+O2(g)== =2HgO(s) ΔH=-181.6 kJ·mol-1则反应Zn(s)+HgO(s)===ZnO(s)+Hg(l)的ΔH为( )
=2HgO(s) ΔH=-181.6 kJ·mol-1则反应Zn(s)+HgO(s)===ZnO(s)+Hg(l)的ΔH为( )
A.+519.4 kJ·mol-1 B.+259.7 kJ·mol-1
C.-259.7 kJ·mol-1 D.-519.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)①根据下列图示,写出反应的热化学方程式:________________________________。
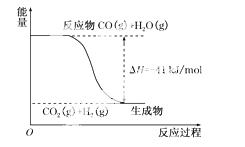
②根据下图所示情况,判断下列说法中正确的是_________________________________
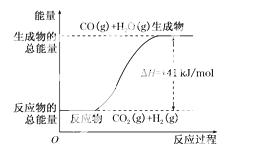
A.其热化学方程式为:CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=+41 kJ/mol
B.该反应为吸热反应
C.该反应为放热反应
D.当H2O为液态时,其反应热值小于41 kJ/mol
(2)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,
该反应的热化学方程式是_________________________________________________ _。
_。
(3)下图是某温度下,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为:
______ ____________________________________________。
____________________________________________。
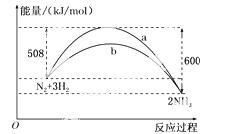
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W、R五种短周期非金属主族元素在元素周期表中的位置如图所示,下列有关说法正确的是( )
| X | Y | ||
| Z | W | R |
A.Z位于第三周期ⅤA族
B.X、Y的气态氢化物的稳定性:X>Y
C.原子半径大小顺序:Z>W>Y
D.W、R的最高价氧化物对应水化物的酸性:W>R
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子反应方程式为( )
A.NH4HCO3溶于过量的浓KOH溶液中:NH4++ HCO3-+2OH-= CO32-+ NH3↑+2 H2O
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:
2Al3++3SO42-+3Ba2++6OH -=2 Al(OH)3↓+3BaSO4↓
C.向FeBr2溶液中通入少量氯气:2Fe2++4Br-+3Cl2=2 Fe3++2 Br2+6 Cl-
D.醋酸除去水垢:2H++CaCO3=Ca2++ CO2↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
请回答下列问题:
(1)该反应平衡常数表达式为K=______ ;ΔH 0(选填“>”、“<”或“=”)。
(2)830 ℃时,向一个5 L的密闭容器中充入0.20 mol的A和0.80 mol的B,若测得反应初始至6 S内A的平均反应速率v(A)=0.003 mol · L-1· S-1,则6 S时c(A)=______ mol·L-1;C的物质的量为______ mol 。
(3)在与(2)相同的温度、容器及A、B配比下反应经一段时间后达到平衡,此时A的转化率为______;如果这时向该密闭容器中再充入1 mol氩气,则平衡时A的转化率_ (选填“增大”、“减小”、“不变”)。
(4)判断该反应是否达到平衡的依据为______(填正确选项的字母)。
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(5)1200 ℃时反应C(g)+D(g)  A(g)+B(g)的平衡常数的值为______ 。
A(g)+B(g)的平衡常数的值为______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
依据下列甲、乙、丙三图,判断下列叙述不正确的是( )
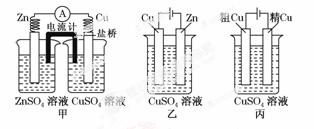
A.甲是原电池,乙是电镀装置
B.甲、乙装置中,锌极上均发生氧化反应
C.乙、丙装置中,阳极均发生氧化反应而溶解
D.乙、丙装置中,c(Cu2+)基本不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com