
| A组 | B组 |
| Ⅰ.H-I键键能大于H-Cl键键能 Ⅱ.H-I键键能小于H-Cl键键能 Ⅲ.HI分子间作用力大于HCl分子间作用力 Ⅳ.HI分子间作用力小于HCl分子间作用力 | ①HI比HCl稳定 ②HI比HCl不稳定 ③HI沸点比HCl高 ④HI沸点比HCl低 |
| A. | Ⅰ、① | B. | Ⅳ、② | C. | Ⅲ、③ | D. | Ⅱ、④ |
分析 根据键能越大,物质的热稳定性越强;根据组成和结构相似的分子,相对分子质量越大,分子间作用力越强,物质的熔沸点越高.
解答 解:Ⅰ、HCl比HI稳定,是由于H-Cl键键能大于H-I键键能,故错误;
Ⅱ、HCl比HI稳定,是由于H-Cl键键能大于H-I键键能,故错误;
Ⅲ、HI沸点比HCl高,是由于HI的相对分子质量大于HCl的相对分子质量,HI分子间作用力大于HCl分子间作用力,故正确;
Ⅳ、HI沸点比HCl高,是由于HI的相对分子质量大于HCl的相对分子质量,HI分子间作用力大于HCl分子间作用力,故错误;
故选C.
点评 本题主要考查了键能与物质的热稳定性、相对分子质量与物质的熔沸点之间的关系,掌握规律是解题的关键.


 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:rX>rY>rW>rQ | |
| B. | 工业上常用电解的方法制备X,Y的单质 | |
| C. | 元素Q和Z能形成QZ2的共价化合物为原子晶体 | |
| D. | 元素X、Y的最高价氧化物对应水化物之间不能反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
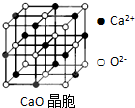
 ,ci2与ce2比较,沸点较高的是CS2(写分子式).
,ci2与ce2比较,沸点较高的是CS2(写分子式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ①⑥ | C. | ①④ | D. | ①④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥⑦ | B. | ③⑤⑦ | C. | ③⑥⑦ | D. | ⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液质量增加 | B. | 溶液的温度降低 | ||
| C. | 晶体不再溶解 | D. | 溶液的温度和质量都不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上,可以由下列反应合成三聚氰胺:
工业上,可以由下列反应合成三聚氰胺: .其中氮原子的杂化方式有sp2、sp3.
.其中氮原子的杂化方式有sp2、sp3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com