
氧化还原反应综合应用:氧化还原反应滴定
(1)配平氧化还原反应方程式:
C2O42-+____MnO4-+____H+===____CO2↑+_ ___Mn2++____H2O
___Mn2++____H2O
(2 )称取6.0 g含
)称取6.0 g含 H2C2O4·2H2O、KHC2O4和K2
H2C2O4·2H2O、KHC2O4和K2 SO4的试样,加水溶解,配成250 mL溶液。量取两份此溶液各25 mL,分别置于两个锥形瓶中。
SO4的试样,加水溶解,配成250 mL溶液。量取两份此溶液各25 mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25 mol·L-1 NaOH溶液至20 mL时,溶液由无色变为浅红色。该溶液被中和的H+的总物质的量为________mol。②第二份溶液中滴加0.10 mol·L-1的酸性高锰酸钾溶液。
A.KMnO4溶液在滴定过程中作________(填“氧化剂”或“还原剂”),该滴定过程________(填“需要”或“不需要”)另加指示剂。滴至16 mL时反应完全,此时溶液颜色由________变为________。
B.若在接近终点时,用少量蒸馏水将锥形瓶冲洗一下,再继续滴定至终点,则所测结果________(填“偏大”、“偏小”或“无影响”)。
C.若在达到滴定终点时俯视读数,则所得结果________(填“偏大”、“偏小”或“无影响”)。
③原试样中H2C2O4·2H2O的质量分数为________,KHC2O4的质量分数为________。
解析 (1)C:+3―→+4,改变量(4-3)×2=2,Mn:+7―→+2,改变量(7-2)×1=5,根据化合价升降总数相等,所以在C2O42-前配5,MnO4-前配2,根据C和Mn原子守恒,分别在CO2和Mn2+前配10和2,再由电荷守 恒在H+前配16,最后根据离子方程式两边的H原子个数相等在水前面配8,经检验离子方程式的氧原子个数相等。
恒在H+前配16,最后根据离子方程式两边的H原子个数相等在水前面配8,经检验离子方程式的氧原子个数相等。
(2)①由H++OH-===H2O知,n(H+)=n(OH-)=0.25 mol·L-1×0.02 L=0.005 mol。②原溶液无色,而KMnO4为紫红色,所以当溶液中的H2C2O4和KHC2O4反应完全时,溶液呈浅紫红色。由得失电子守恒得,n(还)×2=0.10 mol·L-1×0.016 L×5,n(还)=0.004 mol。③设6.0 g试样中H2C2O4·2H2O、KHC2O4的物质的量分别为n(H2C2O4·2H2O)、n(KHC2O4),由①得:2n(H2C2O4·2H2O)+n(KHC2O4)=0.05 mol,由②得:n(H2C2O4·2H2O)+n(KHC2O4)=0.04 mol,解上述两个方程式得:n(H2C2O4·2H2O)=0.01 mol,n(KHC2O4)=0.03 mol,H2C2O4·2H2O的质量分数为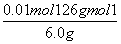 ×100%=21%,KHC2O4的质量分数为
×100%=21%,KHC2O4的质量分数为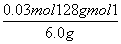 ×100%=64%。
×100%=64%。
答案 (1)5 2 16 10 2 8
(2)①0.005 ②A.氧化剂 不需要 无色 浅紫红色 B.无影响 C.偏小 ③21% 64%


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
醋酸是中学常用的一种弱酸。
(1)取0.10mol CH3COOH作导电性实验,
测得其导电率随加入的水量变化如图所示:
开始时导电率为0说明: 。
② 比较a、 b点的相关性质(填“>”、“<”、“=”):
n(H+):a b;c(CH3COO-):a b;
完全中和时消耗NaOH的物质的量:a b;
③ 若b点时,溶液中c(CH3COOH)=0.10mol/L,c(H+)=1.3×10-3mol/L,则此时c(CH3COO-)约为 mol/L;计算b点时醋酸的电离平衡常数,写出计算过程 。
(2)已知:H+(aq) + OH-(aq) = H2O(l) △H1=-57.3 kJ/mol
CH3COOH(aq) 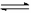 H+(aq) +CH3COO-(aq) △H2=+1.3 kJ/mol
H+(aq) +CH3COO-(aq) △H2=+1.3 kJ/mol
写出稀醋酸与稀烧碱溶液反应的热化学方程式:
。
(3)室温下,取浓度均为0.10mol/L的醋酸与醋酸钠溶液等体积混合后,测得其pH<6,写出混合溶液中的物料守恒关系式 ;并列出其中的离子浓度大小顺序(由大到小) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学反应限度的叙述中正确的是( )
A.化学反应的限度都相同 B.可以通过改变反应条件控制化学反应的限度
C.可以通过延长化学反应的时间改变化学反应限度
D.当一个化学反应在一定条件下达到限度时反应即停止
查看答案和解析>>
科目:高中化学 来源: 题型:
O3具有强氧化性,将O3通入KI溶液中发生反应:O3+I-+H+―→I2+O2+H2O(未配平),下列说法正确的是 ( )。
A.配平后的离子方程式为2O3+2I-+4H+===I2+2O2+2H2OB.每生成1 mol I2转移电子2 mol
C.O2是还原产物之一
D.该反应能说明O2的氧化性大于I2的
查看答案和解析>>
科目:高中化学 来源: 题型:
近年来地质、环境灾难频频发生,为防止在大灾之后疫病流行,灾区需要大量的各种消毒剂、漂白剂等。
(1)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3与SO2在H2SO4作用下反应制得。请写出反应的离子方程式:_________________________________________________________________。
(2)过碳酸钠是一种新型固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了氧化反应的是________。
A.MnO2 B.KMnO4溶液
C.稀盐酸 D.Na2SO3溶液
(3)漂白剂亚氯酸钠(NaClO2)在常温下黑暗处可保存一年,HClO2不稳定可分解,反应的离子方程式为HClO2―→ClO2↑+H++Cl-+H2O(未配平)。当1 mol HClO2分解时,转移的电子数是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
Fe(OH)3胶体虽然是由FeCl3溶液制得,但两者是截然不同的两种物质。FeCl3溶液、Fe(OH)3胶体共同具备的性质是 ( )。
A.都呈透明的红褐色
B.分散质颗粒直径相同
C.都比较稳定,密封保存一段时间都不会产生沉淀
D.当有光线透过时,都能产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于铁的叙述正确的是 ( )。
①铁能被磁铁吸引,但纯铁易被腐蚀 ②在人体内的血红蛋白中含有铁元素 ③铁位于元素周期表中第四周期第ⅧB族 ④铁能在氧气中剧烈燃烧,但不能在水蒸气中燃烧 ⑤铁与强氧化剂硝酸反应的产物仅是Fe(NO3)3 ⑥不能通过化合反应制得FeCl2和Fe(OH)3
A.①③ B.②④ C.②⑤ D.④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。下列关于这两种有机化合物的说法正确的是
A.两种酸都能与溴水反应
B.两种酸遇三氯化铁溶液都显色
C.鞣酸分子与莽草酸分子相比多了两个碳碳双键
D.中和等物质的量的两种酸消耗的氢氧化钠的量相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com