
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:
| 元素编号 | 元素特征信息 |
| A | A的单质是密度最小的物质 |
| B | B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D与B同周期,该周期中D的简单离子半径最小 |
| E | B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F | F元素最高正价与最低负价的代数和为4 |
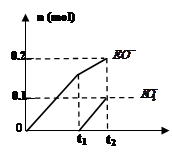
⑴H++HSO3-=SO2↑+H2O(2分) ⑵ S2->Cl->Al3+(2分) ⑶30%(2分)
⑷10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O (2分)
⑸NaH+CH3CH2OH→CH3CH2ONa+H2↑(2分)
解析试题分析:A的单质是密度最小的物质,故A是氢元素;B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子,且B是短周期元素,所以B是钠元素;C的原子最外层电子数是其内层电子数的三倍,且C是短周期元素,所以C是氧元素;D与B同周期,该周期中D的简单离子半径最小,故D是铝元素;B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分,消毒剂的主要成分是次氯酸钠,所以E是氯元素;F元素最高正价与最低负价的代数和为4,且F是短周期元素,所以F是硫元素。
(1)两种均含A、B、C、F四种元素的化合物在溶液中相互反应,则两种化合物应该是硫酸氢钠和亚硫酸氢钠,二者反应的离子方程式为H++HSO3-=SO2↑+H2O。
(2)离子核外电子层数越多,离子半径越大。核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,所以D、E、F的简单离子半径由大到小的顺序是S2->Cl->Al3+。
(3)铁与铝与稀硫酸反应生成硫酸铝和硫酸亚铁,加入双氧水后硫酸亚铁被氧化生成硫酸铁,然后再加入过量氢氧化钠溶液生成氢氧化铁和偏铝酸钠,过滤洗涤干燥后氢氧化铁分解生成氧化铁。该固体的质量和原混合物的质量恰好相等,这说明氧化铁中氧元素的质量等于原混合物中D单质的质量,所以原混合物中D单质的质量分数=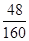 ×100%=30%。
×100%=30%。
(4)根据图像可知生成物次氯酸钙与氯酸钙的物质的量之比=2:1,由于二者是还原产物,其中氯元素的化合价从0价分别降低到+1价和+5价,所以根据电子的得失守恒可知,氧化产物氯化钙的物质的量与氯酸钙、次氯酸钙的物质的量之比=7:1:2,因此该反应的离子方程式为10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O。
(5)乙醇中羟基氢原子的活泼性较强,因此NaH与乙醇反应的化学方程式为NaH+CH3CH2OH→CH3CH2ONa+H2↑。
考点:考查元素周期表的结构、元素周期律的应用以及氧化还原反应的有关判断和计算


科目:高中化学 来源: 题型:填空题
元素周期表前四周期A、B、C、D、E五种元素,A元素的原子最外层电子排布式为ms1;B元素的原子价电子排布式为ns2np2;C元素位于第二周期且原子中p能级与s能级电子总数相等;D元素原子的M能层的p能级中有3个未成对电子;E元素原子有五个未成对电子。
(1)写出元素名称:C 、D 、E 。
(2)C基态原子的电子排布图为___________________,若A为非金属元素,则按原子轨道的重叠方式,A与C形成的化合物中的共价键属于________键(填“σ”或“π”)。
(3)当n=2时,B的最简单气态氢化物的电子式为____________,BC2分子的结构式是 ______________;当n=3时,B与C形成的化合物与氢氧化钠溶液反应的离子方程式是 。 (4)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,A、B、C、D四种元素的第一电离能由大到小的顺序是__________________(用元素符号表示)。
(5)E元素原子的特征电子构型是 ,在元素周期表中位置是 ,其最高价氧化物的化学式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C及B、D分别是同一主族元素,B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的两倍,又知四种元素的单质中有两种气体、两种固体。
(1) A ;D (填元素名称)
(2)写出C、D两元素形成的常见化合物的电子式 ;写出由A、B两元素形成的18电子微粒中所含化学键类型 。
(3)用A元素的单质与B元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH溶液,两极均有特制的防止气体透过的隔膜。在一极通人A的单质,另一极通人B的单质,写出该电池发生的电极反应式:
通入A单质的一极: ;
通入B单质的一极: 。
(4)由A、B、C 三元素构成的化合物X,常在试验制备过程中起尾气吸收作用。请写出化合物X吸收NO2 时所发生反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表为元素周期表的一部分,其中编号代表对应的元素。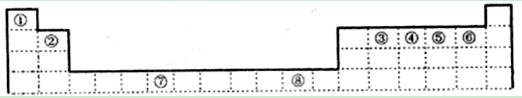
请回答下列问题:
(1)写出元素⑦的基态原子外围电子排布式 ,元素⑧位于 区。
⑤元素原子的价层电子的轨道表示式为 ,
(2)若元素①③⑤形成的某化合物显酸性,经测定这三种元素的质量比为1:6:16,该化合物对氢气的相对密度为23,则其中所有杂化原子的杂化方式分别为 和 。
(3)元素③④⑤⑥的第一电离能由大到小的顺序是 (用元素符号表示)。请写出由④和⑤两种元素形成的与N3ˉ互为等电子体的分子的化学式 ,
(写出一种即可)其VSEPR构型为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
根据表中信息回答下列问题。
| 元素 | Si | P | S | Cl |
| 单质与氢气 反应的条件 | 高温 | 磷蒸气与氢气能反应 | 加热 | 光照或点燃时发生爆炸而化合 |
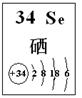
| 编号 | 性质推测 | 化学方程式 |
| 1 | 氧化性 | H2SeO3+4HI=Se↓+2I2+3H2O |
| 2 | | |
| 3 | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题: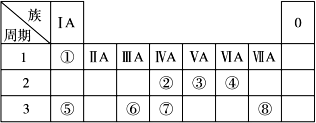
(1)地壳中含量居于第二位的元素在周期表中的位置是________________。
(2)②的最高价氧化物固态时的晶体类型:______________;⑦的最高价氧化物固态时的晶体类型:______________。
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式______________,______________。若用球棍模型表示①和④形成的化合物的分子结构,应该是_____________。
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是( )
| A.最高正化合价为+6价, | B.气态氢化物比H2S稳定, |
| C.最高价氧化物的水化物的酸性比硫酸弱, | D.单质在常温下可与氢气化合。 |
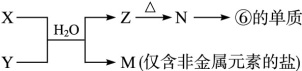
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,Y的最高正价与最低负价的代数和为2,Z与X原子最处层电子数相同。回答下列问题:
(1)X、Y和Z的元素符号分别为 、 、_ 。
(2)选用以上元素组成一种离子化合物,该化合物为______ 。
(3)X和Y组成的化合物Q中,既含有极性共价键又含有非极性共价键,Q的分子式是 。Q在空气中点燃时,迅速而安全的燃烧,其反应产物没有任何污染,燃烧时的化学方程式为 ;Q还可将酸性工业废水中的Cr2O72-还原为Cr3+,氧化产物为常见气体。相应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
常见元素X、Y、Z、W的原子序数依次增大,其相关信息如下表:
| 元素 | 相关信息 |
| X | X的基态原子核外只有三个能级,且各能级电子数相等 |
| Y | Y的基态原子最外层电子数是其内层电子总数的2.5倍 |
| Z | Z的基态价电子结构为nsn-1 |
| W | W单质常在火山口附近被发现,其氧化物是造成酸雨的主要原因之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知A、B、C、D、E是短周期的五种元素,它们的原子序数依次增大。A是短周期元素中原子半径最小的元素;C、D、E三种元素的最高价氧化物对应水化物之间可以两两反应;A与C同主族;B与E同主族;E的单质为淡黄色晶体。
(1)写出E元素在周期表中的位置 ;
(2)写出C元素的离子结构示意图 ;
(3)写出化合物A2B的电子式 ;
(4)写出C、D的最高价氧化物对应水化物相互反应的化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com