
| A. | 3种 | B. | 5种 | C. | 8种 | D. | 9种 |
分析 分子式为C5H12O的有机物,能与金属钠反应放出氢气,说明分子中含有-OH,该物质为戊醇,书写戊基-C5H11异构体,戊基异构数目等于戊醇的异构体数目.
解答 解:分子式为C5H12O的有机物,能与金属钠反应放出氢气,说明分子中含有-OH,该物质为戊醇,戊基-C5H11可能的结构有:-CH2CH2CH2CH2CH3、-CH(CH3)CH2CH2CH3、-CH(CH2CH3)2、-CHCH(CH3)CH2CH3、-C(CH3)2CH2CH3、-C(CH3)CH(CH3)2、-CH2CH2CH(CH3)2、-CH2C(CH3)3,所以该有机物的可能结构有8种.
故选C.
点评 本题考查有机物的推断、同分异构体的书写等,难度中等,利用烃基异构判断,比书写戊醇的同分异构体简单容易.


科目:高中化学 来源: 题型:选择题
| A. | 使用漂白液时不可与酸性洁厕剂混用 | |
| B. | 淘米水中含有淀粉可以直接检测加碘盐中是否含有碘元素 | |
| C. | 葡萄糖、油脂、蛋白质等进入人体内经水解后被吸收 | |
| D. | 铝壶表面有致密氧化膜耐腐蚀,可长期存放食醋 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S的漂白性 | B. | S的还原性 | C. | SO2的漂白性 | D. | SO2的还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
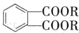 (代号DMP)是一种常用的酯类塑化剂,其相对分子质量为194.工业上生产DMP的流程如图所示:
(代号DMP)是一种常用的酯类塑化剂,其相对分子质量为194.工业上生产DMP的流程如图所示: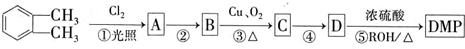
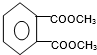 .
. .
.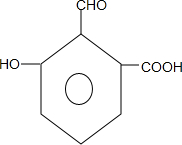 .
.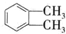 制备DMP的另一种途径:
制备DMP的另一种途径: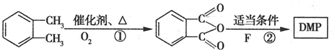
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往反应后的溶液中加入AgNO3溶液检验是否有Br-生成 | |
| B. | 实验中观察不到有气体生成 | |
| C. | 生成的气体可直接通入到溴水中检验是否有乙烯生成 | |
| D. | 生成的气体可直接通入到酸性高锰酸钾溶液中检验是否有乙烯生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
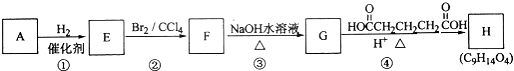
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 步骤①中当v正(CrO42-)=2v逆(Cr2O72-)时,说明反应:2CrO42-+2H+?Cr2O72-+H2O 达到平衡状态 | |
| B. | 若向K2Cr2O7溶液中加NaOH浓溶液,溶液可由橙色变黄色 | |
| C. | 步骤②中,若要还原1 mol Cr2O72-离子,需要12 mol (NH4)2Fe(SO4)2 | |
| D. | 步骤③中,当将溶液的pH 调节至5 时,可认为废水中的铬元素已基本除尽(当溶液中c(Cr3+)≤10-5 mol/L时,可视作该离子沉淀完全) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
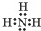 ;NH3在同族元素形成的氢化物中具有较高的沸点,其原因是NH3分子间有氢键.
;NH3在同族元素形成的氢化物中具有较高的沸点,其原因是NH3分子间有氢键.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用氨水鉴别Al3+、Mg2+和Ag+ | |
| B. | 用盐酸、BaCl2溶液鉴别Cl-、SO42-和CO32- | |
| C. | 用溴水鉴别CH4和C2H4 | |
| D. | 用KMnO4酸性溶液鉴别CH3CH2OH和CH3CHO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com