
| A、X:3d64s2 Y:2s22p4 |
| B、X:2s22p3Y:2s22p4 |
| C、X:3s23p1Y:3s23p4 |
| D、X:3s2Y:3s23p5 |


科目:高中化学 来源: 题型:
| A | B | C | D | |
| X | 白色沉淀 | 白色沉淀 | 白色沉淀 | 无现象 |
| 稀硝酸 | 沉淀不消失 | 沉淀消失 有气体产生 | 沉淀不消失 | 无现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向盐酸中滴加氨水:H++OH-=H2O |
| B、Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| C、铜溶于稀硝酸:3Cu+8H++2NO3-=3Cu2++2 NO↑+4H2O |
| D、CuSO4溶液与Ba(OH)2溶液混合:Cu2++SO42-+2OH-+Ba2+=BaSO4↓+Cu(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
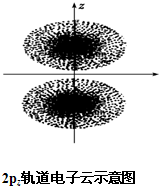 如图是2pz轨道电子云的示意图,请观察图,并判断下列说法中不正确的是( )
如图是2pz轨道电子云的示意图,请观察图,并判断下列说法中不正确的是( )| A、2pz轨道上的电子在空间出现的概率分布是z轴对称 |
| B、点密集的地方表明电子出现的机会多 |
| C、电子先沿z轴正半轴运动,然后在负半轴运动 |
| D、2pz轨道形状为两个椭圆球 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1个甘氨酸分子中存在10对共用电子 |
| B、PCl3和了BCl3分子中所有原子的最外层都达到8电子稳定结构 |
| C、维勒用无机物合成了尿素,突破了无机物与有机物的界限 |
| D、熔点由高到低的顺序是:金刚石>碳化硅>晶体硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 实验结论 |
| (1)将混合物溶于水,得到无色透明溶液 | 原混合物肯定无 |
| (2)取少量上述溶液两份,其中一份加入BaCl2溶液,立即产生白色沉淀,再加入稀硝酸,沉淀不溶解 | 原混合物肯定有 |
| (3)在另一份溶液中加入NaOH溶液,也产生白色沉淀 | 原混合物肯定有 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合溶液的pH=7 | ||
B、若混合溶液中c(H+)=
| ||
| C、若混合溶液pH=4,则水电离出的c(H+)=1.0×10-10mol?L-1 | ||
| D、若HA为强酸,则混合后溶液中各离子浓度的大小关系一定为:c(A-)>c(B+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com