
分析 (1)C3H6催化还原尾气中的NO气体,可以得到无毒的气体氮气和二氧化碳;
(2)②×2+③×2-①得到2NO(g)+2CO(g)?N2(g)+2CO2(g),据此计算反应的焓变;
(3)电解反应中阴极上发生得电子的还原反应,根据反应原理来回答书写;
(4)①反应平衡常数K=$\frac{产物平衡浓度系数次幂之积}{反应物平衡浓度系数次幂之积}$;
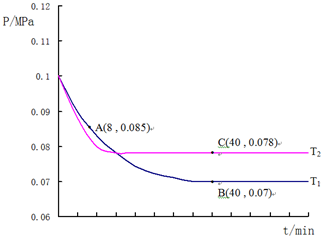
②结合化学三行计算列式,依据图中A点时,气体物质的量0.085,依据开始和A点气体物质的量之比列式计算,转化率=$\frac{变化量}{起始量}$×100%;
③图中B点,依据化学三行列式计算用平衡分压代替平衡浓度计算,分压=总压×物质的量分数计算SO2催化氧化反应在图中B点的压强平衡常数;
④先拐先平温度高,达到平衡所需时间短,温度越高反应速率越大.
解答 解:(1)C3H6催化还原尾气中的NO气体,可以得到无毒的气体氮气和二氧化碳,即2C3H6+18NO=6CO2+6H2O+9N2,
故答案为:2C3H6+18NO=6CO2+6H2O+9N2;
(2))②×2+③×2-①得到2NO(g)+2CO(g)?N2(g)+2CO2(g),反应的焓变=2(+110.5kJ•mol-1)+2(-393.5kJ•mol-1)-(180.5kJ•mol-1)=-746.5kJ•mol-1,
故答案为:-746.5kJ•mol-1;
(3)电解反应中阴极上发生得电子的还原反应,2HSO3-+2H++2e-=S2O42-+2H2O,
故答案为:2HSO3-+2H++2e-=S2O42-+2H2O;
(4)①2SO2(g)+O2(g)?2SO3,反应的平衡常数K=$\frac{{C}^{2}(S{O}_{3})}{{C}^{2}(S{O}_{2})×C({O}_{2})}$,
故答案为:$\frac{{C}^{2}(S{O}_{3})}{{C}^{2}(S{O}_{2})×C({O}_{2})}$;
②设氧气消耗物质的量为x,
2SO2(g)+O2(g)?2SO3
起始量(mol) 2a a 0
变化量(mol) 2x x 2x
平衡量(mol)2a-2x a-x 2x
图中A点时,气体物质的量0.085,则$\frac{2a-2x+a-x+2x}{2a+a}$=$\frac{0.085}{0.1}$,x=0.45a
SO2的转化率=$\frac{0.45a×2}{2a}$×100%=45%,
故答案为:45%;
③图中B点,设氧气消耗物质的量为y,
2SO2(g)+O2(g)?2SO3
起始量(mol) 2a a 0
变化量(mol) 2y y 2y
平衡量(mol) 2a-2y a-y 2y
B点气体物质的量为 0.007,则$\frac{2a-2y+a-y+2y}{2a+a}$=$\frac{0.07}{0.1}$,y=0.9a,
平衡常数K=$\frac{(0.007×\frac{1.8}{0.2a+0.1a+1.8a})^{2}}{(0.007×\frac{0.2a}{0.2a+0.1a+1.8a})^{2}×(0.007×\frac{0.1a}{0.2a+0.1a+1.8a})}$=24300(MPa)-1,
故答案为:24300(MPa)-1;
④图象分析可知,先拐先平温度高则T1<T2,C点是平衡状态,A点反应未达到平衡状态,其中C点的正反应速率vC(正)与A点的逆反应速率vA(逆)的大小关系为vC(正)>vA(逆)
故答案为:<;>.
点评 本题考查了化学平衡、化学反应速率影响因素的分析应用,图象变化和数值的计算是解题关键,题目难度中等.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯化铁腐蚀铜板:Fe3++Cu═Fe2++Cu2+ | |
| B. | 实验室制氯气:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++2Cl2↑+2H2O | |
| C. | 稀硫酸中加氢氧化钡到溶液呈中性:Ba2++H++OH-+SO42-═BaSO4↓+H2O | |
| D. | 氢氧化钠溶液中吸收少量二氧化硫:2OH-+SO2═SO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 砷(As)是第四周期第VA族元素,它在自然界中的含量不高,但人类认识它、研究它的历史却很长.
砷(As)是第四周期第VA族元素,它在自然界中的含量不高,但人类认识它、研究它的历史却很长.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
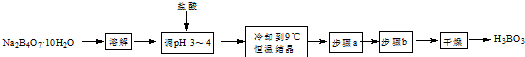
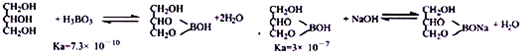
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 甲烷在一定条件下可生成以下微粒:
甲烷在一定条件下可生成以下微粒:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com