
| A、25℃时,pH=13的氨水中含有OH-的数目为0.1NA |
| B、标准状况下,2.24 LNO2 与水反应生成NO3-的数目为0.1NA |
| C、1 mol Na被完全氧化生成Na2O2,转移电子的数目为NA |
| D、将100 mL 0.1 mol?L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA |


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
| A、c(H+)=1×10-7mol?L-1的溶液 |
| B、水电离的H+和OH-浓度相等的溶液 |
| C、pH+pOH=14的溶液 |
| D、pH=pOH的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol Cl2与足量Fe反应,转移的电子数为3NA |
| B、在25℃、101 kPa时,22.4 L氢气中含有NA个氢分子 |
| C、常温常压下,11.2LN2中含有的分子数为0.5NA |
| D、1L 0.5mol?L-1Na2SO4溶液中含有的钠离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HNO3的摩尔质量为63 |
| B、摩尔是物质的量的单位 |
| C、1mol任何物质都约含有6.02×1023个原子 |
| D、64g SO2中含有1mol O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊:CO32-+CO2+H2O=2HCO3- |
| B、实验室制备NH3:NH4++OH-=NH3↑+H2O |
| C、SO2使酸性KMnO4溶液褪色:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+ |
| D、已知电离平衡常数K(H2CO3)>K(H2S)>K(HCO3-),则Na2CO3+H2S═Na2S+H2O+CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| A | 氨气 | 硫酸 | 小苏打 | 氧化钙 | 干冰 |
| B | 苛性钠 | 盐酸 | 食盐 | 氧化钠 | 一氧化碳 |
| C | 石灰水 | 冰醋酸(CH3COOH) | 胆矾 CuSO4?5H2O | 过氧化钠 | 二氧化硫 |
| D | 苛性钠 | HNO3 | 碳酸钙 | 氧化铁 | SO3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
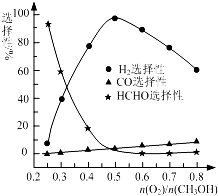 甲醇来源丰富、价格低廉、运输贮存方便,有着重要的用途和应用前景.
甲醇来源丰富、价格低廉、运输贮存方便,有着重要的用途和应用前景.| 1 |
| 2 |
| 1 |
| 2 |
| n(O2) |
| n(CH3OH) |
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com