分析:(1)若乙为乙醇,金属A的组成元素是短周期主族元素中原子半径最大的元素为Na,乙醇在非金属单质B中反应可能是燃烧生成二氧化碳或一氧化碳,催化氧化生成乙醛,最后生成乙酸;
(2)若乙为单质,其原子中最外层电子数是其电子层数的2倍,判断乙为C或S,A为钾,乙和甲反应生成甲为K
2S,所以推断乙为S,B与A同主族,用pH试纸测定甲溶液和丙溶液的酸碱性,试纸分别呈蓝色说明是呈碱性,硫离子水解显碱性,乙和非金属单质B反应生成的丙溶液呈红色说明是酸性溶液,推断为H
2S,B为H
2;
①题干信息可知,A为K,A的组成元素在周期表中的位置第四周期第ⅠA族;
②丙为H
2S,溶液使pH试纸变红色的原因是硫化氢水溶液中存在电离平衡电离出氢离子
③甲溶液为Na
2S的溶液,溶液中硫离子分步水解显碱性
-;
(3)若甲是磁性氧化铁,乙是水,则金属A为Fe,B为碳,丙是水煤气为H
2、CO;
①依据题干书写热化学方程式,结合盖斯定律计算得到所需热化学方程式;
②平衡常数是利用生成物平衡浓度幂次方乘积,除以反应物幂次方乘积得到;依据平衡三段式列式计算转化率=
×100%;
③元素化合价从+3价变化为+2价,元素化合价降低,做氧化剂被还原发生还原反应.
解答:
解:(1)若乙为乙醇,金属A的组成元素是短周期主族元素中原子半径最大的元素为Na,反应的化学方程式为:2CH
3CH
2OH+2Na→2CH
3CH
2ONa+H
2↑;乙醇在非金属单质B中反应可能是燃烧生成二氧化碳或一氧化碳,催化氧化生成乙醛,最后生成乙酸;
故答案为:2CH
3CH
2OH+2Na→2CH
3CH
2ONa+H
2↑;CO或CO
2或CH
3CHO或CH
3COOH;
(2)若乙为单质,其原子中最外层电子数是其电子层数的2倍,判断乙为C或S,A为钾,乙和甲反应生成甲为K
2S,所以推断乙为S,B与A同主族,用pH试纸测定甲溶液和丙溶液的酸碱性,试纸分别呈蓝色说明是呈碱性,硫离子水解显碱性,乙和非金属单质B反应生成的丙溶液呈红色说明是酸性溶液,推断为H
2S,B为H
2;
①题干信息可知,A为K,A的组成元素在周期表中的位置第四周期第ⅠA族;
故答案为:第四周期第ⅠA族;
②丙为H
2S,溶液使pH试纸变红色的原因是硫化氢水溶液中存在电离平衡电离出氢离子,H
2S?H
++HS
-;
故答案为:H
2S?H
++HS
-;
③甲溶液为Na
2S的溶液,溶液中各种阴离子浓度由大到小的顺序为:S
2->OH
->HS
-;
故答案为:S
2->OH
->HS
-;
(3)①已知相同条件下当1摩气态水参加反应时,反应①的焓变△H=+a kJ?mol
-1,反应的热化学方程式为:3Fe(s)+4H
2O(g)=Fe
3O
4(s)+4H
2,△H=+aKJ/mol;反应②的焓变△H=+b kJ?mol
-1,热化学方程式为:C(s)+H
2O(g)=CO(g)+H
2(g)△H═+b kJ?mol
-1;则依据盖斯定律计算,②×4-①得到相同条件下Fe
3O
4固体与固态碳反应生成固态Fe和气态CO的热化学方程式为:Fe
3O
4(s)+4C(s)=3Fe(s)+4CO(g)△H=(4b-a)KJ/mol;
故答案为:Fe
3O
4(s)+4C(s)=3Fe(s)+4CO(g)△H=(4b-a)KJ/mol;
②密闭容器中反应Fe
3O
4(s)+4CO(g)═3Fe(s)+4CO
2(g)为可逆反应,反应的平衡常数K=
;某温度下该反应K=8.1×10
-3,该温度下在密闭容器中加入1.0mol Fe
3O
4 和5.2mol CO,依据平衡三段式列式得到,设消耗一氧化碳物质的量为x;
Fe
3O
4(s)+4CO(g)═3Fe(s)+4CO
2(g)
起始量(mol) 1.0 5.2mol 0 0
变化量(mol) x x
平衡量(mol) 5.2-x x
=8.1×10
-3;
x=1.2mol
平衡时CO的转化率=
×100%=23.1%;
故答案为:23.1%;
③氧化铁可以转化为磁性氧化铁,铁元素化合价降低,说明做氧化剂被 还原发生还原反应;
故答案为:还原.

 .
.

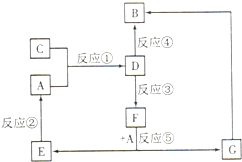 A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素.已知:
A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素.已知: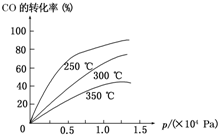 工业上一般在密闭容器中采用下列反应合成甲醇:
工业上一般在密闭容器中采用下列反应合成甲醇: