
| A、X与Y形成化合物,X可以显负价,Y显正价 |
| B、第一电离能可能Y小于X |
| C、气态氢化物的稳定性:HmY小于HnX |
| D、最高价含氧酸的酸性:X对应的酸性弱于于Y对应的 |


 英才计划期末调研系列答案
英才计划期末调研系列答案 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:
| A、煤经过气化和液化两个物理变化,可变为清洁能源 |
| B、古代的陶瓷、砖瓦,现代的有机玻璃、水泥都是硅酸盐产品 |
| C、明矾可用于水的消毒、杀菌:碳酸钡可用于钡餐透视 |
| D、单晶硅太阳能电池板可以将太阳能直接转变为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝热剂就是单指Fe2O3粉和铝粉的混合物 |
| B、检验红砖中的红色物质是否是Fe2O3的操作步骤是:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 |
| C、分别还原a mol Fe2O3所需H2、Al、CO的物质的量之比为2:3:2 |
| D、明矾属硫酸盐,是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ;a与b形成化合物的电子式为:
;a与b形成化合物的电子式为: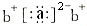 .下列叙述正确的是( )
.下列叙述正确的是( )| A、原子半径:a>c>d |
| B、非金属性:c>a>d |
| C、相应氢化物的沸点:d>c>a |
| D、c与a、c与b均能形成两种化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电负性用来描述不同元素的原子对键合电子吸引力的大小 |
| B、电负性是以氟为4.0、锂为1.0作为标准的相对值 |
| C、元素电负性越小,元素非金属性越强 |
| D、元素电负性越大,元素非金属性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
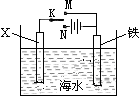 已知海水中含有的离子主要有Na+、Mg2+、Cl-、Br-,利用如图装置进行实验探究,下列说法正确的是( )
已知海水中含有的离子主要有Na+、Mg2+、Cl-、Br-,利用如图装置进行实验探究,下列说法正确的是( )| A、X为锌棒,K置于M,可减缓铁的腐蚀,铁电极上发生的反应为2H++2e-=H2↑ |
| B、X为锌棒,K置于M,外电路电流方向是从X到铁 |
| C、X为碳棒,K置于N,可减缓铁的腐蚀,利用的是外加电流的阴极保护法 |
| D、X为碳棒,K置于N,在X电极周围首先失电子的是Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,0.5 mol SO3中含有1.5NA个O原子 |
| B、常温常压下,22 g 14CO2中所含分子数为0.5NA |
| C、室温下,1 L pH=1的H2SO4溶液中含有的H+数目为0.2NA |
| D、7.8g Na2O2与足量水反应,转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
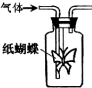 如图集气瓶中用滤纸折成的纸蝴蝶上喷洒了一种溶液,通入某种气体后,实验结果与预测的纸蝴蝶颜色变化不一致的是( )
如图集气瓶中用滤纸折成的纸蝴蝶上喷洒了一种溶液,通入某种气体后,实验结果与预测的纸蝴蝶颜色变化不一致的是( )| A | B | C | D | |
| 喷洒液 | 酚酞 | 紫色石蕊 | 酸性高锰酸钾 | 酸化的KI-淀粉 |
| 通入的气体 | NH3 | Cl2 | CH2=CH2(g) | NO2 |
| 预测的颜色变化 | 变为红色 | 最终褪色 | 褪色 | 无明显变化 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
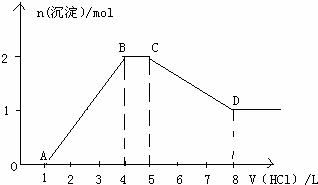
| 阴离子种类 | |||||
| 物质的量浓度(mol/L) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com