
分析 (1)根据价层电子对互斥理论确定原子杂化方式及分子空间构型;
(2)高温下,B的三溴化物和P的三溴化物在氢气的氛围中合成BP,根据反应物、生成物及反应条件书写方程式;
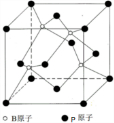
(3)晶体中B与G原子的最近距离为anm,即a×10-7cm, ,图中1、2、3、4原子形成正四面体结构,这四个原子之间的B原子位于正四面体体心上,1、5原子之间的距离为a×10-7cm,顶点到体心距离与体心到底面距离之比为3:1,则其高为$\frac{4}{3}$×a×10-7cm,设1、2原子之间距离为x,1、2、3原子形成的正三角形底面的高=$\frac{\sqrt{3}}{2}$x,正三角形顶点到中心的距离与中心到底的距离之比为2:1,所以正三角形顶点到中心的距离=$\frac{\sqrt{3}}{2}x×\frac{2}{3}$=$\frac{\sqrt{3}}{3}x$,由1、2、5构成直角三角形中存在x2=($\frac{\sqrt{3}}{3}x$)2+($\frac{4}{3}$×a×10-7)2,x=$\frac{2\sqrt{6}}{3}$×a×10-7,则晶胞棱长=$\sqrt{\frac{(2x)^{2}}{2}}$cm=$\frac{4}{\sqrt{3}}×a×1{0}^{-7}$cm,晶胞体积=($\frac{4}{\sqrt{3}}×a×1{0}^{-7}$)3cm3,晶胞密度=$\frac{m}{V}$.
,图中1、2、3、4原子形成正四面体结构,这四个原子之间的B原子位于正四面体体心上,1、5原子之间的距离为a×10-7cm,顶点到体心距离与体心到底面距离之比为3:1,则其高为$\frac{4}{3}$×a×10-7cm,设1、2原子之间距离为x,1、2、3原子形成的正三角形底面的高=$\frac{\sqrt{3}}{2}$x,正三角形顶点到中心的距离与中心到底的距离之比为2:1,所以正三角形顶点到中心的距离=$\frac{\sqrt{3}}{2}x×\frac{2}{3}$=$\frac{\sqrt{3}}{3}x$,由1、2、5构成直角三角形中存在x2=($\frac{\sqrt{3}}{3}x$)2+($\frac{4}{3}$×a×10-7)2,x=$\frac{2\sqrt{6}}{3}$×a×10-7,则晶胞棱长=$\sqrt{\frac{(2x)^{2}}{2}}$cm=$\frac{4}{\sqrt{3}}×a×1{0}^{-7}$cm,晶胞体积=($\frac{4}{\sqrt{3}}×a×1{0}^{-7}$)3cm3,晶胞密度=$\frac{m}{V}$.
解答 解:(1)BBr3分子中每个B原子连接3个Br原子且不含孤电子对,所以B原子价层电子对个数是3,所以B原子采用杂化sp2,PBr3分子中P原子价层电子对个数是3且不含孤电子对,所以其空间构型为三角锥形,
故答案为:sp2;三角锥;
(2)高温下,B的三溴化物和P的三溴化物在氢气的氛围中合成BP,根据反应物、生成物及反应条件书写方程式为BBr3+PBr3+3H2$\frac{\underline{\;高温\;}}{\;}$BP+6HBr,故答案为:BBr3+PBr3+3H2$\frac{\underline{\;高温\;}}{\;}$BP+6HBr;
(3)晶体中B与G原子的最近距离为anm,即a×10-7cm, ,图中1、2、3、4原子形成正四面体结构,这四个原子之间的B原子位于正四面体体心上,1、5原子之间的距离为a×10-7cm,顶点到体心距离与体心到底面距离之比为3:1,则其高为$\frac{4}{3}$×a×10-7cm,设1、2原子之间距离为x,1、2、3原子形成的正三角形底面的高=$\frac{\sqrt{3}}{2}$x,正三角形顶点到中心的距离与中心到底的距离之比为2:1,所以正三角形顶点到中心的距离=$\frac{\sqrt{3}}{2}x×\frac{2}{3}$=$\frac{\sqrt{3}}{3}x$,由1、2、5构成直角三角形中存在x2=($\frac{\sqrt{3}}{3}x$)2+($\frac{4}{3}$×a×10-7)2,x=$\frac{2\sqrt{6}}{3}$×a×10-7,则晶胞棱长=$\sqrt{\frac{(2x)^{2}}{2}}$cm=$\frac{4}{\sqrt{3}}×a×1{0}^{-7}$cm,晶胞体积=($\frac{4}{\sqrt{3}}×a×1{0}^{-7}$)3cm3,
,图中1、2、3、4原子形成正四面体结构,这四个原子之间的B原子位于正四面体体心上,1、5原子之间的距离为a×10-7cm,顶点到体心距离与体心到底面距离之比为3:1,则其高为$\frac{4}{3}$×a×10-7cm,设1、2原子之间距离为x,1、2、3原子形成的正三角形底面的高=$\frac{\sqrt{3}}{2}$x,正三角形顶点到中心的距离与中心到底的距离之比为2:1,所以正三角形顶点到中心的距离=$\frac{\sqrt{3}}{2}x×\frac{2}{3}$=$\frac{\sqrt{3}}{3}x$,由1、2、5构成直角三角形中存在x2=($\frac{\sqrt{3}}{3}x$)2+($\frac{4}{3}$×a×10-7)2,x=$\frac{2\sqrt{6}}{3}$×a×10-7,则晶胞棱长=$\sqrt{\frac{(2x)^{2}}{2}}$cm=$\frac{4}{\sqrt{3}}×a×1{0}^{-7}$cm,晶胞体积=($\frac{4}{\sqrt{3}}×a×1{0}^{-7}$)3cm3,
该晶胞中B原子个数为4、P原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞密度=$\frac{m}{V}$=$\frac{\frac{M}{{N}_{A}}×4}{V}$=$\frac{\frac{42}{{N}_{A}}×4}{(\frac{4}{\sqrt{3}}×a×1{0}^{-7})^{3}}$g/cm3=$\frac{42×4}{{N}_{A}×(\frac{4}{\sqrt{3}}×a×1{0}^{-7})^{3}}$g/cm3,
故答案为:$\frac{42×4}{{N}_{A}×(\frac{4}{\sqrt{3}}×a×1{0}^{-7})^{3}}$.
点评 本题考查晶胞计算,侧重考查学生计算、空间想象能力,明确正四面体中棱长与高的关系是解本题关键,结合密度公式进行解答,题目难度中等.


科目:高中化学 来源: 题型:填空题
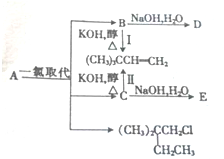 (1)A的分子式为C6H14,1molA完全燃烧消耗O29.5mol.
(1)A的分子式为C6H14,1molA完全燃烧消耗O29.5mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
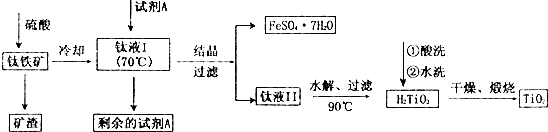
| A. | 过滤 | B. | 蒸发浓缩冷却结晶过滤 | ||
| C. | 水洗 | D. | 灼烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙苯
乙苯  2,3-二甲基戊烷
2,3-二甲基戊烷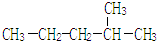 2-甲基戊烷
2-甲基戊烷 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 空气是一种宝贵的资源 | |
| B. | 空气中氮气的质量分数为78% | |
| C. | 氧气易溶于水,供给水生生物呼吸 | |
| D. | 汽车尾气随意排放,与雾霾形成无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 加入物质 | 碳酸钠溶液 | 氢氧化钡溶液 | 氧化铜粉末 |
| 现象 | 产生无色气体 | 产生白色沉淀 | 固体溶解 |
| A. | HCl | B. | CaCl2 | C. | MgSO4 | D. | H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一种离子对带异性电荷离子的吸引作用与其所处的方向无关,故离子键无方向性 | |
| B. | 因为离子键无方向性,故阴、阳离子的排列是没有规律的、随意的 | |
| C. | 因为氯化钠的化学式是NaCl,故每个Na+周围吸引一个Cl- | |
| D. | 因为离子键无饱和性,故一种离子周围可以吸引任意多个带异性电荷的离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com