

 = 1.414,
= 1.414,  =1.732,
=1.732, 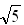 =2.236)
=2.236) 科目:高中化学 来源: 题型:
| 成分 | 含量/(mg L-1) | 成分 | 含量/(mg L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42 | 2560 | Br- | 64 |
| Mg2+ | 1272 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO 42- | HCO 3+ | 含量/mg?L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 成分 | 含量(mg/L) | 成分 | 含量(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Mg2+ | 1272 |

查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市虹口区高三上学期期末教学质量调研化学试卷(解析版) 题型:实验题
精制氯化钾在工业上可用于制备各种含钾的化合物。完成下列填空:
(1)工业氯化钾中含有Fe3+、SO42—、Br—等杂质离子,可按如下步骤进行精制,完成各步内容。
①溶解;②加入试剂至Fe3+、SO42—沉淀完全,煮沸;③_____________________;④加入盐酸调节pH;
⑤___________________(除Br—);⑥蒸干灼烧。
步骤②中,依次加入的沉淀剂是NH3·H2O、________、________。
证明Fe3+已沉淀完全的操作是_________________________________________________。
(2)有人尝试用工业制纯碱原理来制备K2CO3。他向饱和KCl溶液中依次通入足量的______和______两种气体,充分反应后有白色晶体析出。将得到的白色晶体洗涤后灼烧,结果无任何固体残留,且产生的气体能使澄清石灰水变浑浊。
写出生成白色晶体的化学方程式:___________________________________________。
分析该方法得不到K2CO3的原因可能是_______________________________________。
(3) 用氯化钾制备氢氧化钾的常用方法是离子交换膜电解法。氢氧化钾在_________极区产生。为了避免两极产物间发生副反应,位于电解槽中间的离子交换膜应阻止_______(填“阴”、“阳”或“所有”)离子通过。
(4)科学家最近开发了一种用氯化钾制氢氧化钾的方法。其反应可分为5步(若干步已合并,条件均省略)。请写出第⑤步反应的化学方程式。
第①、②步(合并):2KCl + 4HNO3 → 2KNO3 + Cl2 + 2NO2 + 2H2O
第③、④步(合并):4KNO3 + 2H2O → 4KOH + 4NO2 + O2
第⑤步:____________________________________________
总反应:4KCl + O2 + 2H2O → 4KOH + 2Cl2
与电解法相比,该方法的优势可能是______________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年北京市西城区高三上学期期末考试化学试卷 题型:填空题
(12分)海水资源的利用具有广阔前景。海水中主要离子的含量如下:
|
成分 |
含量/(mg L-1) |
成分 |
含量/(mg L-1) |
|
Cl- |
18980 |
Ca2+ |
400 |
|
Na+ |
10560 |
HCO3- |
142 |
|
SO42- |
2560 |
Br- |
64 |
|
Mg2+ |
1272 |
|
|
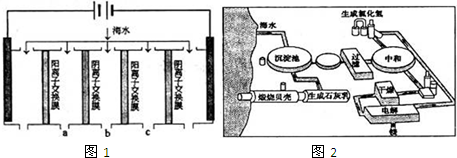
(1)电渗析法淡化海水示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。

①阳极主要电极反应式是 。
②在阴极附近产生少量白色沉淀,其成分有 和CaCO3,生成CaCO3的离子方程式是 。
③淡水的出口为 (填“a”、“b”或“c”)。
(2)利用海水可以提取溴和镁,提取过程如下:

①提取溴的过程中,经过2次Br-→Br2转化的目的是 ,吸收塔中发生反应的离
子方程式是 。用平衡移动原理解释通空气的目的是 。
②从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是 、过滤、洗涤、干燥。
③依据上述流程,若将10 m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为 L(忽略Cl2溶解)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com