
【题目】某学习小组用如图所示A、B装置分别探究金属锌与稀硫酸的反应,实验过程中A装置烧杯内的溶液温度升高,B装置的电流计指针发生偏转。
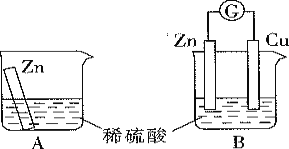
(1)A装置的烧杯中发生反应的离子方程式为________。
(2)B装置中Zn板是________极,Cu板上的现象是________,发生的电极反应式是________。若有1 mol电子流过导线,则正极生成的产物在标准状况下的体积为_______ L。
(3)从能量转化的角度看,A、B中反应物的总能量________(填“大于”“小于”或“等于”)生成物的总能量,A中主要是将化学能转化为________,B中主要是将化学能转化为________。
(4)该小组同学反思原电池的原理,其中观点正确的是________(填字母)。
A.原电池反应的过程中可能没有电子发生转移
B.原电池装置需要2个电极
C.电极一定不能参加反应
D.氧化反应和还原反应可以拆开在两极发生
(5)有人以化学反应:2Zn+O2+4H+=2Zn2++2H2O为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作。则该原电池的负极发生的电极反应为___________。
【答案】Zn+2H+=Zn2++H2↑ 负 有气泡冒出 2H++2e-=H2↑ 11.2 大于 热能 电能 BD Zn-2e-=Zn2+
【解析】
(1)锌与氢离子反应生成锌离子与氢气;
(2)锌铜稀硫酸原电池中,活泼金属锌作负极,锌失电子发生氧化反应,氢离子在正极铜上得电子发生还原反应,铜电极上有气泡冒出,根据电极反应求出氢气的体积;
(3)A烧杯中温度升高,该反应是放热反应;原电池将化学能转化成电能;
(4)A.原电池的本质是有电子转移;
B.原电池的构成条件必须有两个电极;
C.活泼金属作负极失电子发生氧化反应;
D.负极发生氧化反应,正极发生还原反应。
(5)活泼金属锌作负极,锌失电子发生氧化反应。
(1)锌与氢离子反应生成锌离子与氢气,离子方程式为Zn+2H+═Zn2++H2↑;
(2)锌铜稀硫酸原电池中,活泼金属锌作负极,电极反应为Zn-2e-═Zn2+,氢离子在正极铜上得电子产生氢气,铜电极上有气泡冒出,电极反应为2H++2e-═H2↑,若有1 mol电子流过导线,产生氢气0.5mol,则正极生成的产物在标准状况下的体积为0.5mol×22.4L·mol-1=11.2 L;
(3)A烧杯中温度升高,该反应是放热反应,所以反应物总能量大于生成物总能量;A中主要是将化学能转化成热能,B中是原电池,主要将化学能转化成电能;
(4)A.原电池要有自发进行的氧化还原反应发生,一定有电子的转移,故A错误;
B.原电池的构成条件必须有两个电极,故B正确;
C.活泼金属作负极失电子发生氧化反应,正极上得电子发生还原反应,一般负极溶解,正极质量增重或析出气体,故C错误;
D.负极发生氧化反应,正极发生还原反应,故D正确;
故选BD。
(5)活泼金属锌作负极,锌失电子发生氧化反应,原电池的负极发生的电极反应为 Zn-2e-=Zn2+。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:
【题目】下列选项中的反应、现象与结论完全一致的是(夹持、加热装置已略去)
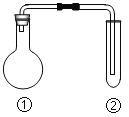
①中的反应 | ②中的现象 | 结论 | |
A | MnO2与浓盐酸加热 | KI淀粉溶液很快变蓝 | Cl2有氧化性 |
B | Cu与浓硫酸加热 | 溴水褪色 | SO2有漂白性 |
C | Na2CO3与醋酸溶液 | 苯酚钠溶液变浑浊 | 酸性:碳酸>苯酚 |
D | 电石与饱和食盐水 | 酸性高锰酸钾溶液褪色 | 乙炔有还原性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来进行储存利用。利用NaOH溶液来“捕捉”CO2的过程如图所示(部分条件及物质未标出)。
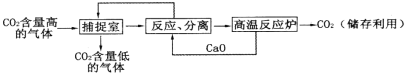
下列说法错误的是
A. 能耗大是该方法的一大缺点
B. 整个过程中,有2种物质可以循环利用
C. “反应、分离”环节中,有复分解反应发生
D. “反应、分离”环节中,分离的基本操作是蒸发、结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体的叙述正确的是
A. 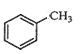 苯环上的一个氢原子被含1个氯原子取代,所得产物有5种
苯环上的一个氢原子被含1个氯原子取代,所得产物有5种
B. 丁烷(C4H10)的二氯取代物只能有4种
C. 菲的结构式为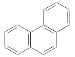 ,其一硝基取代物有10种
,其一硝基取代物有10种
D. 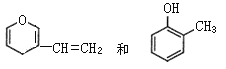 互为同分异构体
互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是

A. 离子半径: X>Y>Z
B. WX3和水反应形成的化合物是离子化合物
C. 最高价氧化物对应的水化物酸性:R>W
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.1molCO2 的质量为44g/molB.CO2的摩尔质量为44g
C.CO2的摩尔质量等于CO2的相对分子质量D.NA个CO2的质量(以克为单位)与CO2的相对分子质量在数值上相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+,又含有Fe3+,将一定量的该磁黄铁矿与100mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成2.4g硫单质,0.425mol FeCl2 和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是
A. 该盐酸的物质的量浓度为4.25mol·L-1
B. 该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为3∶1
C. 成的H2S气体在标准状况下的体积为2.24L
D. 该磁黄铁矿中FexS的x=0.85
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是)
选项 | 已知 | 类推 |
A | 将Fe加入CuSO4溶液中:Fe+Cu2+=== Cu+Fe2+ | 将Na加入到CuSO4溶液中:2Na+Cu2+=== Cu+2Na+ |
B | 向Ca(ClO)2溶液中通入少量CO2:CO2+H2O+Ca2++2ClO-=== CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2:SO2+H2O+Ca2++2ClO-=== CaSO3↓+2HClO |
C | 惰性电极电解氯化钠溶液:2Cl-+2H2O | 惰性电极电解MgBr2溶液:2Br-+2H2O |
D | 稀盐酸与NaOH溶液反应至中性:H++OH-===H2O | 稀硝酸与Ba(OH)2溶液反应至中性:H++OH-===H2O |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.蒸馏时,当烧瓶中液体出现暴沸时,要立即添加碎瓷片
B.在溶解、过滤、蒸发、萃取、分液等操作中均需使用玻璃棒
C.可以用铁丝代替铂丝进行焰色反应
D.用 pH 试纸测定新制氯水的 pH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com