
分析 设浓度均为1mol/L,①中铵根离子水解,②中铵根离子、碳酸氢根离子相互促进水解,③中氢离子抑制铵根离子水解,④中铵根离子浓度最大,以此来解答.
解答 解:设浓度均为1mol/L,①中铵根离子水解,②中铵根离子、碳酸氢根离子相互促进水解,③中氢离子抑制铵根离子水解,④中铵根离子浓度最大,可知c(NH4+)④中略小于2mol/L,③中接近1mol/L,①中略小于1mol/L,③中比①的浓度更小,即c(NH4+)由大到小的顺序是④>③>①>②,
故答案为:④>③>①>②.
点评 本题考查离子浓度大小的比较,为高频考点,把握盐类水解、水解平衡移动为解答关键,侧重分析与应用能力的考查,注意设出溶质的浓度比较更直观,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ③ | ④ | ⑤ | |||||
| 3 | ① | ② | ⑥ | ⑦ | ⑧ | |||
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
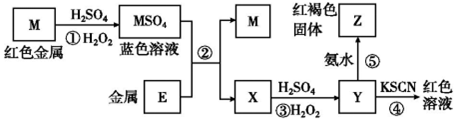
| A. | 在反应①中硫酸既表现了酸性、又表现了氧化性 | |
| B. | 我国是世界上最早使用反应②冶炼金属M的国家 | |
| C. | 在③反应中若不加稀硫酸可能看到红褐色沉淀 | |
| D. | 红褐色固体Z不能溶于氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑ | |
| B. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O | |
| C. | NaClO和NaOH的混合溶液中通入少量的SO2:ClO-+H2O+SO2=C1-+SO42-+2H+ | |
| D. | 大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2、SO3都是极性分子 | |
| B. | KF是离子化合物,HF为共价化合物 | |
| C. | 在NH4+和[Cu(NH3)4]2+中都存在配位键 | |
| D. | PCl3和NF3分子中所有原子的最外层都达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol/L氯化铜溶液中的Cu2+数小于NA | |
| B. | 标准状况下,22.4 L Cl2与水反应转移的电子数为NA | |
| C. | 28 g聚乙烯含有的碳原子数为2NA | |
| D. | 惰性电极电解食盐水,若线路中通过1NA电子电量,则阳极产生气体11.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
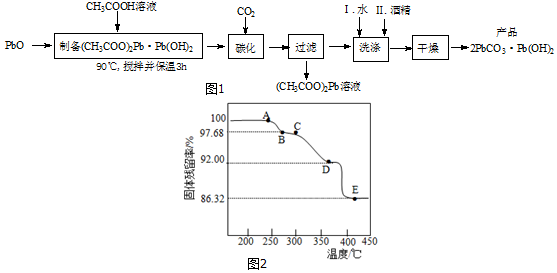
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com