

 .
. .
. 分析 葡萄糖在酒化酶的作用下生成有机物A,A为CH3CH2OH,B是石油化学工业最重要的基础原料,则B为CH2=CH2,A发生消去反应生成B,根据C的分子式可知,A氧化得C为CH3COOH,B和C发生信息中的反应生成D为CH3COOCH=CH2,D发生加聚反应得E为 ,葡萄糖在一定条件下可氧化为X和Y,X的相对分子质量介于A、B之间,Y的相对分子质量与A相同,X可催化氧化成Y,则X为HCHO,Y为HCOOH,X可与H2反应生成Z,则Z为CH3OH,据此答题.
,葡萄糖在一定条件下可氧化为X和Y,X的相对分子质量介于A、B之间,Y的相对分子质量与A相同,X可催化氧化成Y,则X为HCHO,Y为HCOOH,X可与H2反应生成Z,则Z为CH3OH,据此答题.
解答 解:葡萄糖在酒化酶的作用下生成有机物A,A为CH3CH2OH,B是石油化学工业最重要的基础原料,则B为CH2=CH2,A发生消去反应生成B,根据C的分子式可知,A氧化得C为CH3COOH,B和C发生信息中的反应生成D为CH3COOCH=CH2,D发生加聚反应得E为 ,葡萄糖在一定条件下可氧化为X和Y,X的相对分子质量介于A、B之间,Y的相对分子质量与A相同,X可催化氧化成Y,则X为HCHO,Y为HCOOH,X可与H2反应生成Z,则Z为CH3OH,
,葡萄糖在一定条件下可氧化为X和Y,X的相对分子质量介于A、B之间,Y的相对分子质量与A相同,X可催化氧化成Y,则X为HCHO,Y为HCOOH,X可与H2反应生成Z,则Z为CH3OH,
(1)①D为CH3COOCH=CH2,D中官能团的名称是酯基、碳碳双键,
故答案为:酯基、碳碳双键;
②A→B的化学方程式为CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O,
故答案为:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O;
③根据上面的分析可知,E的结构简式为 ,
,
故答案为: ;
;
(2)①A.X为HCHO,室温下,HCHO为气体,故A正确;
B.上述化合物中,有葡萄糖和HCHO及HCOOH都可以发生银镜反应,故B错误;
C.A为CH3CH2OH,Y为HCOOH,它们不是同分异构体,故C错误;
D.A为CH3CH2OH,Z为CH3OH,都具有相同官能团羟基,属于同系物,故D正确,
故选AD;
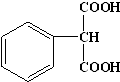
②与葡萄糖相对分子质量相同的芳香族化合物N,即相对分子质量为180,它的苯环上只有一个取代基,1mol N与足量NaHCO3反应,生成44.8L CO2(标准状况)即2mol,所以每个N中有两个羧基,则N的结构简式为 ,
,
故答案为: .
.
点评 本题考查有机物推断及有机物结构和性质,为高频考点,根据反应条件进行推断,正确判断物质结构简式是解本题关键,注意题中信息的利用,题目难度中等.


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①③⑤ | C. | ①②④⑤ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
| A. | 0~6 min的平均反应速率:v(H2O2)≈3.3×10-2 mol/(L•min) | |
| B. | 6~10 min的平均反应速率:v(H2O2)<3.3×10-2 mol/(L•min) | |
| C. | 反应到6 min时,H2O2分解了50% | |
| D. | 反应到6 min时,c(H2O2)=0.30 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加C的量 | |
| B. | 将容器的体积减小一半 | |
| C. | 保持体积不变,充入氮气使体系的压强增大 | |
| D. | 保持压强不变,充入氮气使体系的体积增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ①②③ | C. | ②③④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们的原子序数A>B>C | B. | 它们的离子半径A2->C->B2+ | ||
| C. | 它们的原子半径C>B>A | D. | 它们的最外层电子数C>A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{M}{10Sd}$ mol•L-1 | B. | $\frac{100Sd}{M(100+S)}$ mol•L-1 | ||
| C. | $\frac{10Sd}{M}$mol•L-1 | D. | $\frac{M(100+S)}{1000Sd}$ mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将4mol SO2与2mol O2的混合气分别置于容积相等的甲、乙两容器中,发生反应:2SO2(g)+O2(g)?2SO3(g);△H<0,在相同温度下使其均达到平衡状态.甲是恒压容器,乙是恒容容器.甲容器达到平衡状态时,测得混合气体的物质的量为4.2mol;乙容器经50s达到平衡状态.请回答:
将4mol SO2与2mol O2的混合气分别置于容积相等的甲、乙两容器中,发生反应:2SO2(g)+O2(g)?2SO3(g);△H<0,在相同温度下使其均达到平衡状态.甲是恒压容器,乙是恒容容器.甲容器达到平衡状态时,测得混合气体的物质的量为4.2mol;乙容器经50s达到平衡状态.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01 | B. | 0.02 | C. | 0.03 | D. | 0.06 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com