
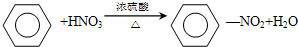
 ,属于取代反应;
,属于取代反应; ,属于加成反应;
,属于加成反应; +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$ +HBr,属于取代反应;
+HBr,属于取代反应;分析 ①乙醇含-OH,与Na发生置换反应生成氢气;
②苯中H被硝基取代,生成硝基苯;
③苯与氢气发生加成反应;
④发生酯化反应生成乙酸乙酯,为取代反应;
⑤苯中H被溴取代生成溴苯;
⑥乙烯含碳碳双键,与HCl发生加成反应.
解答 解:①乙醇含-OH,与Na发生置换反应生成氢气,反应为2Na+2CH3CH2OH→2CH3CH2ONa+H2↑,为置换反应,
故答案为:2Na+2CH3CH2OH→2CH3CH2ONa+H2↑;置换;
②在浓硫酸作催化剂、加热条件下,苯中的氢原子被硝基取代生成硝基苯,所以该反应属于取代反应,反应方程式为 ,
,
故答案为: ;取代;
;取代;
③在镍作催化剂、加热条件下,苯和氢气发生加成反应生成环己烷,该反应属于加成反应,反应方程式为: ,
,
故答案为: ;加成;
;加成;
④乙酸和乙醇在浓硫酸作用下发生酯化反应,生成乙酸乙酯和水,反应方程式为CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O,为取代反应,
故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O;取代;
⑤苯和溴单质在催化剂作用下可以生成溴苯,即 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$ +HBr,为取代反应,
+HBr,为取代反应,
故答案为: +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$ +HBr;取代;
+HBr;取代;
⑥乙烯可以和氯化氢之间发生加成反应生成氯乙烷,化学方程式为CH2═CH2+HCl→CH3CH2Cl,属于加成反应,
故答案为:CH2═CH2+HCl→CH3CH2Cl;加成.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意有机反应类型及反应条件,题目难度不大.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:解答题
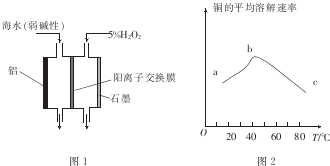
| 实验 体积/mL 液体 | A | B | C | D |
| 0.4mol.L-1Fe2(SO4)3溶液 | 0 | 1.8 | 2.0 | V1 |
| 30%H2O2溶液 | 20.0 | 20.0 | 20.0 | 20.0 |
| HO2 | V2 | V3 | 15.0 | 13.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
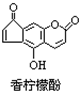
| A. | 它的分子式为C13H9O4 | |
| B. | 它与H2发生加成反应,1mol最多可消耗7mol H2 | |
| C. | 它与溴水发生反应,1mol最多消耗3mol Br2 | |
| D. | 它与NaOH溶液反应,1mol最多消耗2molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤⑧⑨⑩ | B. | ②④⑥⑦ | C. | ②⑤⑦⑧⑩ | D. | ①②③④⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤ | B. | ②③⑤ | C. | ①③④⑤ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:H2SO4>H3PO4 | B. | 非金属性:Cl>S | ||
| C. | 热稳定性Na2CO3>NaHCO3 | D. | 碱性:NaOH>Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/(L•min) | B. | 3.6 mol/(L•min) | C. | 1.2 mol/(L•min) | D. | 0.017mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
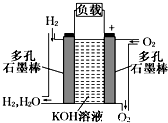 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com