
| 实验顺序 | 实验内容 | 实验现象 |
| ① | A+B | 没有明显变化 |
| ② | B+D | 有无色、无味气体生成 |
| ③ | B+C | 有白色沉淀生成 |
| ④ | A+D | 有白色沉淀生成 |
分析 B和D有气体生成,只有碳酸钠和盐酸反应能生成气体,所以B和D是盐酸和碳酸钠,A和C是氯化钙和硝酸银;A和B 没有现象发生,所以B是盐酸,A是氯化钙,D是碳酸钠,C是硝酸银,根据实验现象结合发生的反应分析解答.
解答 解:(1)B和D有气体生成,只有碳酸钠和盐酸反应能生成气体,所以B和D是盐酸和碳酸钠,A和C是氯化钙和硝酸银;A和B没有现象发生,只有氯化钙和盐酸混合没有现象,所以B是盐酸,A是氯化钙,故D是碳酸钠,C是硝酸银,
故答案为:CaCl2;HCl;AgNO3;Na2CO3;
(2)②B和D是盐酸和碳酸钠,碳酸钠和盐酸反应能生成二氧化碳气体和氯化钠,其反应的离子方程式为:CO32-+2H+=CO2↑+H2O;
③盐酸和硝酸银反应生成氯化银沉淀和硝酸,故离子方程式为:Cl-+Ag+=AgCl↓;
④碳酸钠能与氯化钙反应生成碳酸钙沉淀和氯化钠,故反应的离子方程式为:CO32-+Ca2+=CaCO3↓;
故答案为:CO32-+2H+=CO2↑+H2O;Cl-+Ag+=AgCl↓;CO32-+Ca2+=CaCO3↓.
点评 本题考查了物质的检验鉴别、离子方程式的书写,题目难度不大,明确物质混合是发生的反应以及反应现象即可解答,侧重于考查学生的分析能力和对基础知识的应用能力.


科目:高中化学 来源: 题型:选择题
| A. | CO的燃烧热为566.0 kJ•mol-1 | |
| B. | 反应②△H<0,所以该反应能自发进行 | |
| C. | 使用催化剂能提高其转化率 | |
| D. | 根据①和②推知总反应为2CO(g)+SO2(g)=S(s)+2CO2 (g)△H=-270kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸的电离:H2CO3═2H++HCO3- | |
| B. | 将金属钠加入水中:2Na+2H2O═2Na++2OH-+H2↑ | |
| C. | 硫化钠水解:S2-+2H2O?H2S↑+2OH- | |
| D. | 向氯化铝溶液中加入过量的烧碱溶液:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们所含氧原子数目之比为2:3 | B. | 它们的体积之比为1:1 | ||
| C. | 它们所含原子数目之比为3:4 | D. | 它们的分子数目之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
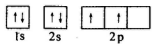 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
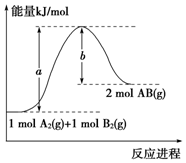
| A. | 每生成2分子AB吸收b kJ热量 | |
| B. | 该反应过程的活化能为b kJ•mol-1 | |
| C. | 断裂1 mol A-A和1 mol B-B键,放出a kJ能量 | |
| D. | 该反应的反应热△H=+(a-b) kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
| CO | Cl2 | COCl2 | COCl2 | ||
| Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
| Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
| Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
| A. | 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol•L-1•min-1 | |
| B. | 该反应正反应为吸热反应 | |
| C. | 容器Ⅱ中起始时Cl2的物质的量为0.55 mol | |
| D. | 若起始时向容器Ⅰ加入CO 0.8 mol、Cl2 0.8 mol,达到平衡时CO转化率小于80% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com