
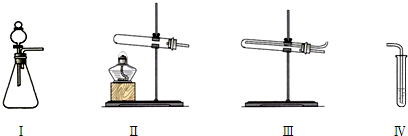
| 操作 | 现象 | |
| 甲 | 向Ⅰ中加入必要的试剂,并向Ⅳ中加入KI、淀粉溶液.连接Ⅰ、Ⅳ,打开活塞 | Ⅰ中剧烈反应,产生无色气体并伴随大量白雾;Ⅳ中有气泡冒出,溶液迅速变蓝 |
| 乙 | 向Ⅱ中加入必要的试剂,并向Ⅳ中加入KI、淀粉溶液和稀硫酸.连接Ⅱ、Ⅳ,点燃酒精灯 | Ⅳ中有气泡冒出,溶液变蓝 |
| 操作 | 现象 | |
| 丙 | 向Ⅰ中加入Na2CO3和稀硫酸,Ⅳ中加入KI、淀粉溶液并在上层覆盖少量煤油.使Ⅰ中发生反应将装置中空气排尽后,再将气体通入Ⅳ的溶液中 | Ⅳ中有气泡冒出,溶液不变蓝 |
| 丁 | 向Ⅰ中加入Na2CO3和稀硫酸,Ⅲ中加入必要试剂,Ⅳ中加入KI、淀粉溶液.依次连接Ⅰ、Ⅲ、Ⅳ,打开活塞 | Ⅳ中有气泡冒出,溶液变蓝 |
分析 (1)①根据装置Ⅰ不需要加热制取氧气可知利用的是双氧水的分解,然后写出反应的化学方程式;
碘离子具有还原性,在酸性条件下能够被氧化氧化成碘单质,据此写出反应的离子方程式;
②证明Ⅰ中产生的气体中含有双氧水,氧气和双氧水都具有氧化性,需要利用不同性质进行检验;
③根据甲和乙的实验操作方法及反应现象得出结论;
(2)①根据丙的操作方法可知,通入碘化钾溶液的气体为纯净的二氧化碳,目的是验证二氧化碳是否氧化碘离子;
②实验丁的目的是验证氧气中含有二氧化碳后,碘化钾溶液是否更容易被氧化,据此可知装置Ⅲ中所盛放的试剂能够与二氧化碳反应生成氧气;
③碘离子与氧气、二氧化碳在溶液中反应生成碘单质和碳酸钾,丁实验后Ⅳ中溶液会含有碳酸根离子,根据具有碳酸根离子的常用方法解答.
解答 解:(1)①装置Ⅰ中不能加热,应该选用双氧水的分解,反应的化学方程式为:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,Ⅳ中有气泡冒出,溶液变蓝,说明氧气将碘离子氧化成碘单质,反应的离子方程式为:O2+4I-+4H+=2I2+2H2O,
故答案为:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑;O2+4I-+4H+=2I2+2H2O;
②a.KMnO4,高锰酸钾溶液能够将双氧水氧化,导致高锰酸钾溶液褪色,而氧气不与高锰酸钾溶液反应,如果高锰酸钾溶液褪色可证明混合气体中含有双氧水,故a正确;
b.FeCl2,氧气和高锰酸钾溶液都能够氧化亚铁离子,无法证明混合气体中含有双氧水,故b错误;
c.Na2S,高锰酸钾和氧气都能够氧化硫化钠,无法用硫化钠检验混合气体中是否含有双氧水,故c错误;
故答案为:a;
③根据甲再次实验后,由于碘化钾不是在酸性条件下,则溶液没有变蓝,而用硫酸酸化的KI溶液容易变蓝,证明了碘化钾溶液在酸性条件下易被O2氧化,
故答案为:KI溶液在酸性条件下易被O2氧化;
(2)①根据丙的操作方法可知,通入碘化钾溶液中的气体只有二氧化碳,而溶液没有变蓝,从而证明CO2不能氧化I-,
故答案为:证明CO2不能氧化I-;
②装置Ⅰ中产生了二氧化碳,装置Ⅲ中应该与二氧化碳反应生成氧气,从而验证氧气中混有二氧化碳后,碘化钾溶液是否被氧化,由于过氧化钠与二氧化碳反应生成碳酸钠和氧气,实验实验装置Ⅲ中盛放的为Na2O2,
故答案为:Na2O2;
③为证明CO2所起的作用,可进行的操作为:取上述丁实验后Ⅳ中溶液滴入CaCl2(或BaCl2)溶液,溶液中如果生成了沉淀,则证明装置Ⅳ中生成的碳酸根离子,二氧化碳在反应中提供氢离子,
故答案为:滴入CaCl2(或BaCl2)溶液.
点评 本题考查了物质性质实验方案的设计与评价,题目难度中等,注意掌握实验室中物质的性质实验方案设计的方法,正确理解实验原理及操作方法为解答关键,试题培养了学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:解答题

| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | |
| 然后溶液从无色逐渐变黄绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和钾的合金可用于快中子反应堆作热交换剂 | |
| B. | 镁与铜、铝等金属形成的合金大量用于制造火箭、飞机、导弹 | |
| C. | 制作印刷电路板时,可用FeCl3溶液腐蚀Cu | |
| D. | 氯气有毒,不能用于药物的合成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅酸、氯化铁溶液均为胶体 | B. | 水玻璃、明矾溶液均为混合物 | ||
| C. | 硫酸、纯碱、NaCl分别属于酸、碱、盐 | D. | KCl和Cu均属于电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
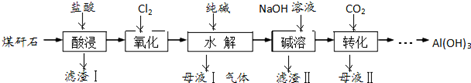
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L该溶液中含有NaOH 4.0 g | |
| B. | 给NaOH溶液通电,使NaOH发生电离 | |
| C. | NaOH的电离方程式是:NaOH═Na++OH- | |
| D. | NaOH溶液能导电,是因为溶液中有自由移动的Na+、OH-离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
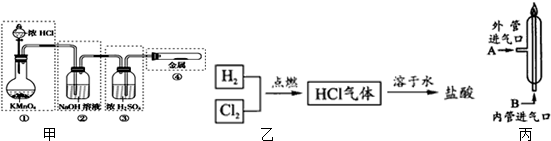
 10HCl□
10HCl□查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com