
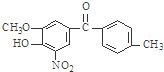
 ,该有机物中含氧官能团有:
,该有机物中含氧官能团有: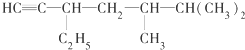 的系统名称是
的系统名称是
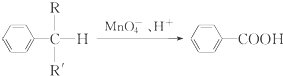 (R、R′表示烷基或氢原子)
(R、R′表示烷基或氢原子)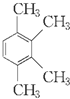 、
、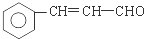 在强氧化剂条件下生成
在强氧化剂条件下生成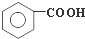 和另一种有机物
和另一种有机物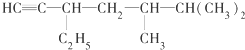 的系统名称为:5,6-二甲基-3-乙基-1-庚烯;将在催化剂
的系统名称为:5,6-二甲基-3-乙基-1-庚烯;将在催化剂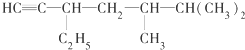 存在下完全氢化,所得烷烃为
存在下完全氢化,所得烷烃为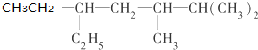 ,该烷烃的系统名称为:2,3-二甲基-5-乙基-庚烷,
,该烷烃的系统名称为:2,3-二甲基-5-乙基-庚烷,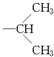 ),两个侧链在苯环上的位置又有邻位、间位和对位3种可能,故分子式为C10H14,有两个侧链的苯的同系物有3×3=9种结构;
),两个侧链在苯环上的位置又有邻位、间位和对位3种可能,故分子式为C10H14,有两个侧链的苯的同系物有3×3=9种结构; ; 9;
; 9;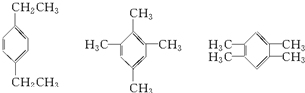 .
. ;
; .
.

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
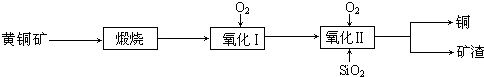
| 沸腾炉温度/℃ | 560 | 580 | 600 | 620 | 640 | 660 |
| 水溶性Cu/% | 90.12 | 91.24 | 93.50 | 92.38 | 89.96 | 84.23 |
| 酸溶性Cu/% | 92.00 | 93.60 | 97.08 | 97.82 | 98.16 | 98.19 |
查看答案和解析>>
科目:高中化学 来源: 题型:
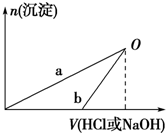 某同学研究铝及其化合物的性质时设计了如下两个实验方案.
某同学研究铝及其化合物的性质时设计了如下两个实验方案.| 100mL稀盐酸 |
| NaOH溶液 |
| 100mLNaOH溶液 |
| 稀盐酸 |
| A、在O点时两方案中所得溶液的溶质物质的量相等 |
| B、b曲线表示的是向X溶液中加入NaOH溶液 |
| C、X溶液溶质为AlCl3,Y溶液溶质为NaAlO2 |
| D、a、b曲线表示的反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
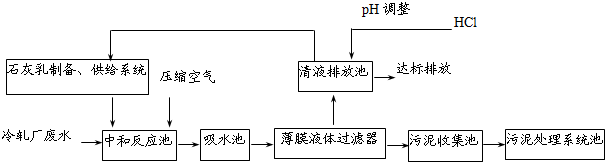
| 冷轧含锌废水水质 | 经处理后的水国家环保标准值 | |
| Zn2+浓度/(mg?L-1) | ≤800 | ≤3.9 |
| pH | 1~5 | 6~9 |
| SO42-浓度/(mg?L-1) | ≤23 000 | ≤150 |
查看答案和解析>>
科目:高中化学 来源: 题型:
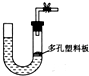
| A、大理石和稀硫酸制取二氧化碳 |
| B、锌粒和稀硫酸制氢气 |
| C、浓盐酸和二氧化锰制取氯气 |
| D、过氧化钠和水制取氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、液体分层,上层为四氯化碳层,黄色 |
| B、液体分层,上层为水层,紫色 |
| C、液体分层,下层为四氯化碳层,紫色 |
| D、液体分层,下层为水层,黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 10 |
| A、①② | B、②④ | C、③④ | D、①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
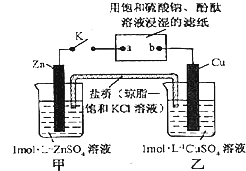
| A、片刻后可观察到滤纸b点变红色 |
| B、电子沿Zn→a→b→Cu路径流动 |
| C、片刻后甲池中c(SO42-)增大 |
| D、Cu电极上发生还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com