
用如图装置进行铁粉在高温下与水蒸气反应的实验,并用简单的方法收集、检验生成的氢气。请回答下列问题:
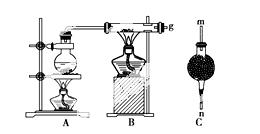
(1)写出铁在高温下与水蒸气反应的化学方程式: _______________________________。
(2)干燥管C内盛放的药品是________。干燥管的________(填“m”或“n”)端与导管口 g 相连接。
(3)若收集到标准状况下的H2为22.4 L,则参加反应的铁粉的质量为________g。
(4)当固体质量增加32 g时,生成H2的质量为________g。
g时,生成H2的质量为________g。
科目:高中化学 来源: 题型:
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
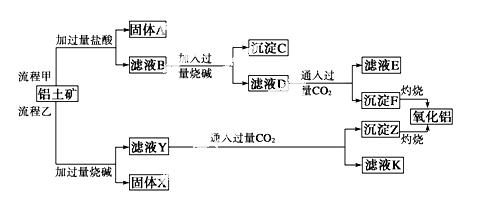
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为_____________________________________。
(2)流程乙加入烧碱后生成SiO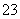 的离子方程式为___________________________。
的离子方程式为___________________________。
(3)验证滤液B中含Fe3+,可取少量滤液并加入________(填试剂名称)。
(4)滤液E、K中溶质的主要成分是__________(填化学式),写出该溶液的一种用途:___________。
(5)已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的滤液B,加入一定量的烧碱达到沉淀溶解平衡,测得pH=13.00,则此温度下残留在溶液中的c( Mg2+)=__________。
Mg2+)=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C为中学常见单质,其中一种为金属,通常情况下,A为固体,B为黄绿色气体,C为无色气体。D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体。它们之间的转化关系如下图所示(其中某些反应条件和部分反应物已略去)。
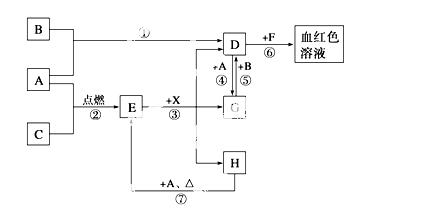
请回答下列问题:
(1)写出下列物质的化学式:A__________、D__________、E__________、X_________。
(2)在反应①~⑦中,不属于氧化还原反应的是__________(填编号)。
(3)反应④的离子方程式是_____________________________________________;
(4)反应⑦的化学方程式是_____________________________________________;
该反应中每消耗0.3 mol的A,可转移电子______mol。
(5)写出D的溶液与小苏打溶液反应的离子方程式是________________________
 _____________________________________________________________________。
_____________________________________________________________________。
(6)除去D溶液中混有的少量G的方法是_________________________________
_____________________________________________________________________。
(7)在D溶液中制备无水D固体的方法是__________________________________
_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质中,满足表中图示物质在通常条件下一步转化关系的组合只有
| 序号 | X | Y | Z | W |
|
| ① | Cu | CuSO4 | Cu(OH)2 | CuO | |
| ② | Na | NaOH | Na2CO3 | NaCl | |
| ③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
| ④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A.①②③ B.①③④ C.②③ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
有NaCl、FeCl2、FeCl3、MgCl2、AlCl3五种溶液,用一种试剂就可把它们鉴别开来,这种试剂是( )
A.盐酸 B.烧碱溶液 C.氨水 D.KSCN溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,反应后固体物质增重的是
A.氢气通过灼热的CuO粉末 B.二氧化碳通过Na2O2粉 末
末
C.铝与Fe2O3发生铝热反应 D.将锌粒投入Cu(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
硅单质及其化合物应用范围很广.
(1)制备硅半导体材料必须先得到高纯硅,工业上可以按如下步骤制备纯硅.
Ⅰ.高温下用碳还原二氧化硅制得粗硅
Ⅱ.粗硅与干燥的氯气在450℃~500℃条件下反应制得SiCl4
Ⅲ.SiCl4液体经精馏提纯后与过量H2在1100℃~1200℃条件下反应制得纯硅
已知SiCl4沸点为57.6℃,能与H2O强烈反应.1 mol H2与SiCl4气体完全反应吸收的热量为120.2 kJ.
请回答下列问题:
①第Ⅲ步反应的热化学方程式是__________________ ____________________
____________________
_______________________________________________________________________。
②整个制备纯硅的过程中必须严格控制无水无氧.SiCl4在潮湿的空气中因水解而产生白色烟雾,其生成物是____________;H2还原SiCl4过程中若混入O2,可能引起的后果是____________.
③上述生产过程所需氯气和氢气均由氯碱厂提供,氯碱厂的基本设备是离子交换膜电解槽(如图所示),其中进入阳极室的溶液是__________________________________,b电极上的电极
反应式是______________________________________________________.

(2)二氧化硅被大量用于生产玻璃.工业上用SiO2、Na2CO3和CaCO3共283 kg在高温下完全反应时放出CO2 44 kg,生产出的玻璃可用化学式Na2SiO3·CaSiO3·xSiO2表示,则其中x=_____ ___。
___。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4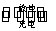
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移
0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题:

(1)A是铅蓄电池的 极,铅蓄电池正极反应式为 ,放电过程中电解液的密度 (填“减小”“增大”或“不变”)。
(2)Ag电极的电极反应式是 ,该电极的电极产物共 g。
(3)Cu电极的电极反应式是 ,CuSO4溶液的浓度 (填“减小”“增大”或“不变”)。
(4)如图表示电解进行过程中某个量(纵坐标x)随时间的变化曲线,则x表示 。
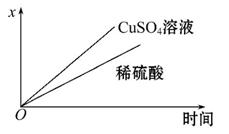
a.各U形管中产生的气体的体积
b.各U形管中阳极质量的减少量
c.各U形管中阴极质量的增加量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com