
下列各组物质相互混合反应后 ,最终有白色沉淀生成的是
,最终有白色沉淀生成的是
①金属钠投入到FeC12溶液中 ②过量NaOH溶液和明矾溶液馄合 ③少量Ca (OH)2投入过量NaHCO3溶液中 ④向NaAlO2溶液中通入过量CO2 ⑤向饱和Na2CO3溶液中通入过量CO2
A.①②③④⑤ B.只有①④ C.只有②③ D.只有③④⑤
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
甲醇(CH3OH)是一种重要的化工原料,合成甲醇的主要反应为:
CO(g)+2H2(g)CH3OH(g) ΔH<0。
Ⅰ.在一定条件下,上述反应在一密闭容器中达到平衡。
(1)体积不变的条件下,下列措施中可能利于提高CO的转化率的是__________(填字母)。
A.升高温度 B.增大压强
C.通入CO D.通入H2
(2)在保证H2浓度不变的情况下,增大容器的体积,平衡__________(填字母)。
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
作出此判断的理由是__________________________。
Ⅱ.原料气的加工过程中常常混有一定量CO2,为了研究不同温度下CO2对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验,结果表明,原料气各组分含量不同时,反应生成甲醇和副产物甲烷的碳转化率是不相同的。实验数据见下表:
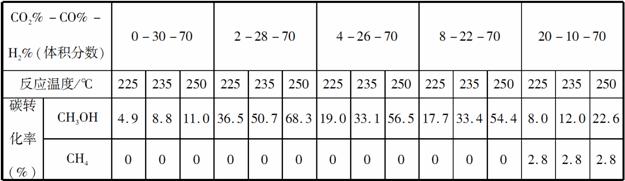
(3)由上表数据可得出多个结论。
结论一:在一定条件下,反应温度越高,碳转化率__________ _______________________________________________。
结论二:_______________________________________________ _____________________________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知有如下转化关系:①C2H5OH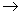 CH3CHO、②C2H4
CH3CHO、②C2H4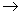 C2H5Br、
C2H5Br、
③C2H5OH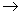 C2H4则反应①、②、③的反应类型分别为 ① 、
C2H4则反应①、②、③的反应类型分别为 ① 、
② 、③ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上消除氮氧化物的污染可用如下反应:
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)
N2(g)+CO2(g)+2H2O(g) 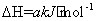
在温度T1和T2时,分别将0.50molCH4和1.2molNO2充入体积为1L的恒容密闭容器中,测得n(N2)随时间变化的数据如下表:
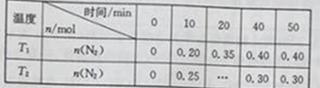
下列说法不正确的是
A. 10 min内,T1时的v(N2)比T2时的小
min内,T1时的v(N2)比T2时的小
B. T1<T2
C. a<0
D. T2时,若向平衡后的容器中再充入1.2molCH4,重新达到平衡时n(N2)=0.40mol
查看答案和解析>>
科目:高中化学 来源: 题型:
硼是一种重要的非金属元素,单质硼可以通过硼镁矿(主要成分为Mg2B2O5·H2O)来制取。
第①步:将硼镁矿用NaOH浓溶液溶解,过滤得NaBO2溶液
第②步:将NaBO2 浓缩后通入CO2调节碱度,结晶析出硼砂Na2B4O7·10H2O
第③步:将硼砂溶于水后,用H2SO4调节碱度,过滤得H3BO3 晶体
第④步:加热硼酸使之脱水生成B2O3。
第⑤步:B2O3用镁还原即得粗单质硼。
请回答下列问题:
(1)已知H3BO3 分子中只含B—O键和O—H键,则H3BO3 的结构式为___________。
(2)第①步反应的化学方程式为_______________________________________;
第③步反应的离子方程式为____________________________________________。
(3)制得的粗硼在一定条件下反应全部化成BI3,然后BI3热分解可以得到纯净的单质硼。由0.25g粗硼制成的BI3分解得到I2全部被收集后,用1.80mol·L-1的Na2S2O3溶液滴定,用去35.00mLNa2S2O3溶液(已知:I2+2S2O32-=2I-+S4O52-)
①盛装Na2S2O3溶液的为____________(填“酸式”或“碱式”)滴定管,滴定过程中所用的指示剂为________________。
②粗硼中硼的含量为__ ________________。
________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某强酸性溶液X中仅含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:
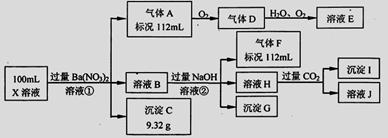
根据以上信息,回答下列问题:
(1)仅根据上述连续实验不能确定溶液X中是否含有的阳、阴离子分别是_____________。
若要用实验证明该阴离子是否存在,最可靠的化学方法是_____________。
(2)尽量用离子方程表达下列反应:
①中生成气体A:_____________。
②中生成溶液H:_____________。
③中产生的气体F遇氯气产生白烟:_____________。
(3)若②中所用氢氧化钠浓度为2mol/L,当加入l0 ml时开始产生沉淀,55 ml时沉淀的量达到最大值0.03 mol,继续滴加沉淀的量保持不变,随后再滴加沉淀部分溶解,到60ml时沉淀的量降为0.025 mol且保持不变,则原溶液中c(Fe2+)为________ ___mol/L、c(Fe3+)为___________mol/L、c(Cl-)为___________mol/L。(若有些离子不存在,请填0 mol/L)
___mol/L、c(Fe3+)为___________mol/L、c(Cl-)为___________mol/L。(若有些离子不存在,请填0 mol/L)
查看答案和解析>>
科目:高中化学 来源: 题型:
G是一种合成橡胶和树脂的重要原料,A是C、H、O三种元素组成的五元环状化合物,相对分子质量为98,其核磁共振氢谱只有一个峰;F的核磁共振氢谱有3个峰,峰面积之比为2:2:3。已知:(其中R是烃基)
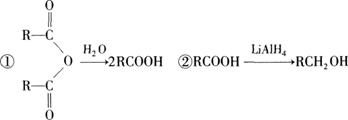
有关物质的转化关系如下图所示,请回答以下问题。
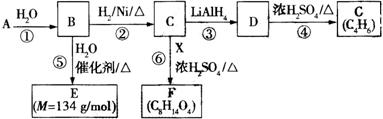
(1)A中不含氧的官能团的名称是 ;⑤的反应类型是 。G的结构简式为 ;G与Br2的CCl4溶液反应,产物有 种(不考虑立体异构)。
(2)反应②的化学方程式为 。
(3)E可在一定条件下通过 (填反应类型)生成高分子化合物,写出该高分子化合物可能的结构简式: (两种即可)。
(4)反应⑥的化学方程式为 。
(5)有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,写出所有符合条件的Y的结构简式: 。Y与足量氢氧化钠溶液反应所得产物之一M,能与灼热的氧化铜反应,写出M与灼热的氧化铜反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在25 ℃时,向100 mL含氯化氢14.6 g的盐酸溶液里放入5.6 g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2 min末收集到氢气1.12 L(已换算为标准状况),在此之后,又经过4 min,铁粉完全溶解。求:
(1)在前2 min内用FeCl2表示的平均反应速率;
(2)在后4 min内用HCl表示的平均反应速率;
(3)前2 min与后4 min相比,反应速率哪个较快?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com