
ijͬѧ��ͭƬ����Ũ�����У����Ⱥ�����Ӧ��̽����Ӧ����������������Ƿ��ж��������ˮ������
��1��д��ͭ��Ũ�����ڼ��������·�Ӧ�Ļ�ѧ����ʽ_______________________________��������������____________��
��2��������ʵ���У�ͭ��Ũ����Ӧ����������_____���A������B����C�����н��з�Ӧ��
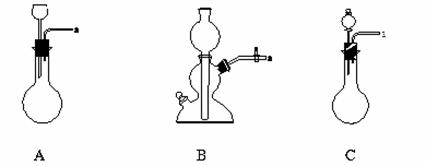
��3����������Ӧװ�ú����м���װ�����ӣ���������������˳��Ϊ�������Ӷ˵����ţ���a��______��______��______��

��4��������ָpHС��____________�Ľ�ˮ���ɶ��������γɵ������к�һ��ǿ�ᣬ������______________�����������γɹ����е���������_________���ѧʽ����
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���з�Ӧ�У��������ȷ�Ӧ����
A�����ý������ᷴӦ B��ú��ȼ�� C������кͷ�Ӧ D����ҵ����ʯ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���á���ش��������⣺
��1����CH4 ����ԭNOx �������������������Ⱦ�����磺
CH4(g) + 4NO2(g) = 4NO(g)��CO2(g) + 2H2O(g) ��H1����574 kJ��mol��1
CH4(g) + 4NO(g) = 2 N2(g)��CO2(g) + 2H2O(g) ��H2��
��1 mol CH4 ��ԭNO2 ��N2�����������зų�������Ϊ867 kJ����H2�� ��
��2����ҵ�ϳɰ�����Ҫ�ķ�Ӧ�����dz����Ҳ����ͣ���һЩ��ѧ�Ҳ��ø����ӵ����Ե�SCY�մɣ��ܴ���H+ ��ʵ�ְ��ĵ绯ѧ�ϳɣ��Ӷ��������˵�����������ת���ʡ��绯ѧ�ϳɰ����̵��ܷ�ӦʽΪ��N2��3H2 2NH3 �����ڵ绯ѧ�ϳɰ��Ĺ����У�������ӦʽΪ ��
2NH3 �����ڵ绯ѧ�ϳɰ��Ĺ����У�������ӦʽΪ ��
��3����һ�������£���l mol N2 ��3 mol H2 �����һ��10 L�ܱ������У���Ӧ�ﵽƽ��ʱ��A���������а�ռ25�����Իش�
��A��ʱN2��Ũ��Ϊ mol/L��
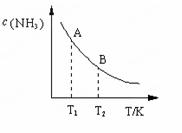 ����ͼ����״̬Aʱ��ƽ�ⳣ�� KA =
����ͼ����״̬Aʱ��ƽ�ⳣ�� KA =
����д������ֵ�ı���ʽ����Ҫ�����¶���T1�仯��T2ʱ��KA KB���>������ <����=������
�����ݻ��̶����ܱ������з���������Ӧ�������ʵ�Ũ�����±���
| ʱ��/min Ũ��/mol•L��1 | c (N2) | c (H2) | c (NH3) |
| 0 | 0.6 | 1.8 | 0 |
| 3 | 0.52 | x | 0.16 |
| 6 | 0.36 | 1.08 | 0.48 |
| 9 | 0.36 | 1.08 | 0.48 |
��Ӧ��3 minʱ�����������˸ı䣬�ı������������ ������ţ���
a��ʹ�ô���
b�������¶�
c������H2��Ũ��
d������Ne����ѹǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
2mol������1 mol������������2 molҺ̬ˮ���ų�571.6kJ����������ȷ��ʾ��һ��Ӧ���Ȼ�ѧ����ʽ��
A��2H2 + O2 �� 2H2O + 571.6kJ
B��2H2(g) + O2(g)�� 2H2O(g)+ 571.6Kj
C��2H2(g) + O2(g) �� 2H2O(l) + 571.6kJ
D��2H2(g) + O2(g) �� 2H2O(l) - 571.6kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���鰱����ѡ�� �� ��
����A��ʪ�����ɫʯ����ֽ���������� B������ĺ�ɫʯ����ֽ
C���������ɫʯ����ֽ���������� D��ʪ��ĺ�ɫʯ����ֽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͬ�������������ʷֱ����Ũ�ȵ�NaOH��Һ��Ӧ������ϵ�о��������ʣ����ļ���������
A��Al������������������ B��Al(OH)3
C��AlCl3 D��Al2O3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ں�1 mol KAl(SO4)2����Һ����μ���2 mol Ba(OH)2��Һ�������й�˵������ȷ����
A�������ɳ����������ȫ���ܽ�
B������Һ��Ba2��ȫ����������ʱ�������������ʵ������
C�����õ��ij�����BaSO4
D�����ij���Ϊ2 mol BaSO4��1 mol Al(OH)3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij����ˮ��Һ�м���Fe2������Һ���ټ�ϡ������Һ������죬��ȡ �þ��壬����NaOH��Һ���Ȳ���һ����ʹʪ���ɫʯ����ֽ���������壬�����־�����
�þ��壬����NaOH��Һ���Ȳ���һ����ʹʪ���ɫʯ����ֽ���������壬�����־�����
A��KSCN B��NH4SCN
C��NH4Cl D��FeCl3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����������X��Һ���ֱ�����ĸ�ʢ��10mL2mol��L��1������ձ��У�����ˮϡ�͵�50mL����ʱX�������ܻ����ؽ��з�Ӧ�����з�Ӧ����������(����)
A��20mL3mol��L��1��X��Һ
B��20mL2mol��L��1��X��Һ
C��10mL4mol��L��1��X��Һ
D��10mL2mol��L��1��X��Һ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com