
| A. | 2-甲基丙烷 | B. | 三硝基甲苯 | C. | 乙酸甲酯 | D. | 乙二酸 |
分析 合物的核磁共振氢谱中出现2组峰,说明有机物中含有2种类型的氢原子峰面积之比是1:1,氢原子数之比为1:1;分子中等效氢原子一般有如下情况:①分子中同一甲基上连接的氢原子等效,②同一碳原子所连甲基上的氢原子等效,③处于镜面对称位置上的氢原子等效,以此来解答.
解答 解:A.2-甲基丙烷的结构简式为CH3CH(CH3)CH3,中含有2种氢原子,核磁共振氢谱能出现两组峰,且其峰面积之比为9:1,故A不选;
B.三硝基甲苯中含有3种氢原子,核磁共振氢谱能出现3组峰,且其峰面积之比为3:1:1,故B不选;
C.乙酸甲酯结构简式为CH3COOCH3,两个甲基所处化学环境不同,故分子中有2种H原子,原子数目之比为3:3,峰面积之比为1:1,故C选;
D.乙二酸构简式为HOOCCOOH,分子的核磁共振氢谱中有两组峰,其峰面积之比是1:1,故D选;
故选CD.
点评 本题考查有机物的结构与性质,为高频考点,把握结构的对称性、核磁共振氢谱确定H的种类为解答的关键,侧重分析与应用能力的考查,注意H原子数目的判断,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 第一次实验平衡时反应放出的热量为294.9kJ | |
| B. | 两次实验平衡时,SO2的转化率相等 | |
| C. | 第二次实验达平衡时SO3的体积分数大于$\frac{2}{9}$ | |
| D. | 达平衡时,O2表示的反应速率为0.25mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
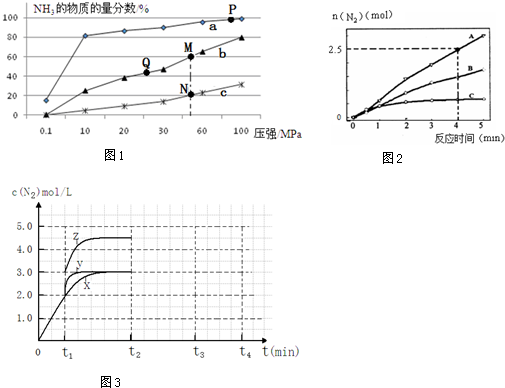
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分解反应 | B. | 置换反应 | C. | 复分解反应 | D. | 化合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去O2中混有的N2:选用灼热的铜网 | |
| B. | 提取碘水中的碘单质:选用有机试剂苯 | |
| C. | 除去CO2中混有的CO:选用适量澄清石灰水 | |
| D. | 除去Mg粉中混有的MgO:选用过量稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
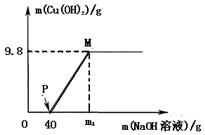 向含CuCl2和HC1的100g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,仅考虑沉淀为Cu(OH)2则下列说法不正确的是( )
向含CuCl2和HC1的100g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,仅考虑沉淀为Cu(OH)2则下列说法不正确的是( )| A. | 整个反应过程中,氯离子个数不变 | |
| B. | M点溶液中的溶质有一种 | |
| C. | P点溶液比M点溶液中氯化钠的质量分数大 | |
| D. | 沉沉完全时,m1的数值为120 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
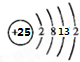 ,其最高正价为+7;是第四周期ⅦB族.
,其最高正价为+7;是第四周期ⅦB族.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
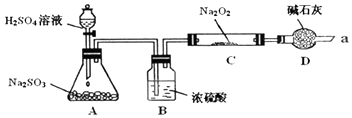
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 26g | B. | 36g | C. | 104g | D. | 37.8g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com