
 铁、铜等金属及其化合物在日常生活中应用广泛,回答下列问题.
铁、铜等金属及其化合物在日常生活中应用广泛,回答下列问题.分析 (1)铜与氯化铁反应生成氯化铁、氯化亚铁,反应方程式为:2FeCl3+Cu═2FeCl2+CuCl2,加入一定量的铁粉后,若无固体剩余,发生2Fe3++Fe=3Fe2+;若有红色固体,发生2Fe3++Fe=3Fe2+、Fe+Cu2+=Fe2++Cu;
(2)根据H2O2的氧化性,在酸性条件下双氧水可以把铜氧化成二价铜离子;
(3)①根据在酸性条件下反应,反应物一定有氢离子,然后根据电子守恒和质量守恒配平方程式;
②根据反应结束时滴入高锰酸钾溶液溶液后颜色变化判断滴定终点;
③根据反应方程式及高锰酸钾的物质的量计算出产品中FeSO4•7H2O的质量分数;
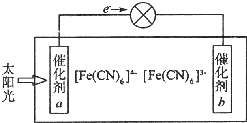
(4)由图可知,电子从负极流向正极,则a为负极,b为正极,负极发生氧化反应,正极发生还原反应,阳离子向正极移动,以此来解答.
解答 解:(1)铜与氯化铁反应生成氯化铁、氯化亚铁,反应方程式为:2FeCl3+Cu═2FeCl2+CuCl2,加入一定量的铁粉后,若无固体剩余,发生2Fe3++Fe=3Fe2+,则溶液中的阳离子为Fe2+、Cu2+;若有红色固体,发生2Fe3++Fe=3Fe2+、Fe+Cu2+=Fe2++Cu,则溶液中肯定没有的离子是Fe3+,检验Fe3+选择KSCN溶液,观察是否出现血红色,若无血红色出现,证明不含,
故答案为:Fe2+、Cu2+;Fe3+; KSCN溶液;
(2)少量铜丝放入适量的稀硫酸中铜丝不与稀硫酸反应,但加入H2O2后由于双氧水具有强氧化性,在酸性条件下可以把铜氧化成二价铜离子,所以方程式为:Cu+H2O2+H2SO4=CuSO4+2H2O,
故答案为:Cu+H2O2+H2SO4=CuSO4+2H2O;
(3)①用硫酸酸化的0.01mol/L KMnO4溶液,所以反应物中一定有氢离子,高锰酸根离子化合价由+7变为+2,降低了5价,亚铁离子与+2变为+3,升高了1价,所以高锰酸根离子系数为1、亚铁离子系数为5,根据电荷守恒、质量守恒配平氢离子、水,配平后的方程式为:5Fe2++1MnO4-+8H+═5Fe3++1Mn2++4H2O,
故答案为:5;1;8;H+;5;1;4;H2O;
②当亚铁离子与高锰酸钾离子完全反应后,再滴入一滴高锰酸钾溶液,溶液会呈淡紫色,据此判断滴定终点,
故答案为:滴定最后一滴酸性KMnO4时溶液呈淡紫色,半分钟内不褪色;
③25mL待测液消耗的高锰酸钾的物质的量为:0.01mol/L×0.04L=0.0004mol,
5.7g产品配成250mL溶液消耗高锰酸钾的物质的量为0.0004mol×$\frac{250}{25}$=0.004mol,
根据反应:5Fe2++1MnO4-+8H+═5Fe3++Mn2++4H2O,硫酸亚铁的物质的量为:0.004mol×5=0.02mol,
所以样品中含有的FeSO4•7H2O的质量为:278g/mol×0.02mol=5.56g,
FeSO4•7H2O的质量分数为:$\frac{5.56g}{5.7g}$×100%≈97.5%,
故答案为:0.975或97.5%.
(4)由图可知,电子从负极流向正极,则a为负极,发生氧化反应,可知催化剂a表面发生反应电极反应为Fe(CN)64--e-═Fe(CN)63-,
故答案为:负;Fe(CN)64--e-═Fe(CN)63-.
点评 本题考查金属及化合物的综合应用,为高频考点,涉及氧化还原反应计算、离子反应、离子检验及原电池的应用等,注重化学反应原理的分析与应用能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 用标准的盐酸溶液滴定含甲基橙的氢氧化钠溶液,终点时溶液由黄色变成橙色 | |
| B. | 将二氧化硫通入氯化钡溶液中产生白色沉淀,再滴加稀硝酸沉淀不消失 | |
| C. | 向葡萄糖溶液中加入新制氢氧化铜,加热至沸腾,静置后上层溶液呈红色 | |
| D. | 海水提取溴的过程不发生氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价化合物中一定不含有离子键,离子化合物中可能含有共价键 | |
| B. | 充电电池的化学反应原理是氧化还原反应 | |
| C. | 一定条件下,将1 mol N2与3 mol H2充入密闭容器中充分反应可生成2 mol NH3 | |
| D. | 质子数相同、电子数也相同的两种微粒,不可能是一种分子和一种离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | B. | c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | ||
| C. | 2c(SO42-)+c(OH-)=c(NH4+)+2c(Fe2+)+c(H+) | D. | c(NH4+)+c(NH3•H2O)=2c(Fe2+)+2c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高锰酸钾 | B. | 氯化铁 | C. | 浓溴水 | D. | 水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应速度一定大于逆反应速度 | B. | 反应物的转化率一定增大 | ||
| C. | 正反应速率一定增大 | D. | 生成物的质量分数一定增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
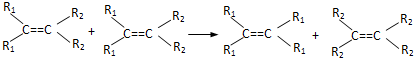
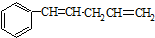 发生烯烃的复分解反应时,不可能生成的产物是( )
发生烯烃的复分解反应时,不可能生成的产物是( )| A. | 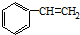 | B. | 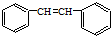 | C. | CH2=CHCH3 | D. | 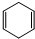 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com