

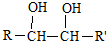 $\stackrel{HIO_{4}}{→}$RCHO+R′CHO
$\stackrel{HIO_{4}}{→}$RCHO+R′CHO . B→H的反应类型是取代反应.
. B→H的反应类型是取代反应.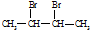 +2NaOH
+2NaOH CH3-C≡C-CH3+2NaBr+2H2O.
CH3-C≡C-CH3+2NaBr+2H2O.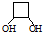 .
. 分析 根据信息反应(1),B生成C,说明B分子对称,又A生成B,则A与B碳原子数相同,A和G互为同分异构体,A不能使Br2的CCl4溶液褪色,所以A含有4个碳原子,不含碳碳双键,所以B也含4个碳原子,则B为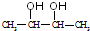 ,A为
,A为 ,B与HBr发生取代反应生成H,则H为
,B与HBr发生取代反应生成H,则H为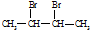 ,H生成I,I中所有碳原子均在一条直线上,则I为CH3-C≡C-CH3,又B发生信息反应(1)生成C,则C为CH3CHO,C与银氨溶液反应在水浴加热的条件下生成D,D在酸化生成E,则E为CH3COOH,由E与F在浓硫酸加热条件下发生酯化反应生成G,则F为醇,C发生还原反应生成F为CH3CH2OH,G为CH3COOCH2CH3,据此分析解答.
,H生成I,I中所有碳原子均在一条直线上,则I为CH3-C≡C-CH3,又B发生信息反应(1)生成C,则C为CH3CHO,C与银氨溶液反应在水浴加热的条件下生成D,D在酸化生成E,则E为CH3COOH,由E与F在浓硫酸加热条件下发生酯化反应生成G,则F为醇,C发生还原反应生成F为CH3CH2OH,G为CH3COOCH2CH3,据此分析解答.
解答 解:根据信息反应(1),B生成C,说明B分子对称,又A生成B,则A与B碳原子数相同,A和G互为同分异构体,A不能使Br2的CCl4溶液褪色,所以A含有4个碳原子,不含碳碳双键,所以B也含4个碳原子,则B为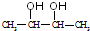 ,A为
,A为 ,B与HBr发生取代反应生成H,则H为
,B与HBr发生取代反应生成H,则H为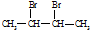 ,H生成I,I中所有碳原子均在一条直线上,则I为CH3-C≡C-CH3,又B发生信息反应(1)生成C,则C为CH3CHO,C与银氨溶液反应在水浴加热的条件下生成D,D在酸化生成E,则E为CH3COOH,由E与F在浓硫酸加热条件下发生酯化反应生成G,则F为醇,C发生还原反应生成F为CH3CH2OH,G为CH3COOCH2CH3,
,H生成I,I中所有碳原子均在一条直线上,则I为CH3-C≡C-CH3,又B发生信息反应(1)生成C,则C为CH3CHO,C与银氨溶液反应在水浴加热的条件下生成D,D在酸化生成E,则E为CH3COOH,由E与F在浓硫酸加热条件下发生酯化反应生成G,则F为醇,C发生还原反应生成F为CH3CH2OH,G为CH3COOCH2CH3,
(1)根据以上分析,F为CH3CH2OH,分子式为C2H6O;C与银氨溶液反应在水浴加热的条件下生成D,故答案为:C2H6O;银氨溶液,水浴加热;
(2)根据以上分析,A的结构简式为 ,B与HBr发生取代反应生成H,故答案为:
,B与HBr发生取代反应生成H,故答案为: ;取代反应.
;取代反应.
(3)B与HBr发生取代反应生成H,则H为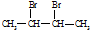 ,H生成I,I中所有碳原子均在一条直线上,则I为CH3-C≡C-CH3,则H转化为I的化学方程式为
,H生成I,I中所有碳原子均在一条直线上,则I为CH3-C≡C-CH3,则H转化为I的化学方程式为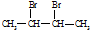 +2NaOH
+2NaOH 
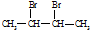 +2NaOH
+2NaOH 
(4)X是A的一种同分异构体,则分子式为C4H8O2,1molX在HIO4加热条件下完全反应,可以生成1mol无支链的有机物,则X为环状结构,则X的结构简式为 ,故答案为:
,故答案为: .
.
点评 本题考查有机物的推断,为高考常见题型,侧重于考查学生分析能力、推断能力和综合运用化学知识的能力,题目难度中等,注意把握题给信息,为解答该题的关键.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )| A. | Z的氧化物对应的水化物一定是一种强酸 | |
| B. | 原子半径大小顺序是X>Y>Z | |
| C. | Y的单质比Z的单质更易与氢气反应 | |
| D. | Z的单质与Fe反应形成的化合物中,铁元素显+3价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
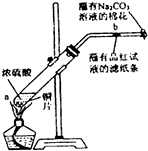
 用如图所示装置检验对应气体时,不能达到目的是( )
用如图所示装置检验对应气体时,不能达到目的是( )| 生成的气体 | 试剂X | 试剂Y | |
| A | 电石与水反应制取的乙炔 | CuSO4溶液 | Br2的CCl4溶液 |
| B | 木炭与浓H2SO4加热制取的二氧化碳 | 饱和NaHCO3溶液 | 澄清石灰水 |
| C | CH3CH2Br与NaOH乙醇溶液共热制取的乙烯 | 水 | KMnO4酸性溶液 |
| D | C2H5OH与浓H2SO4加热至170℃制取的乙烯 | NaOH溶液 | Br2的CCl4溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
| n(CO) | n(H2O) | n(CO2) | n(H2) | ||
| ① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
| ② | 0 | 0 | 1 | 4 | 热量变化:Q1 |
| ③ | 1 | 1 | 2 | 1 | 热量变化:Q2 |
| A. | 若容器①中反应10min达到平衡,0至10min时间内,用CO表示的平均反应速率υ(CO)=4.0×10-2 mol/(L•min) | |
| B. | 容器③中,开始时υ(CO)生成>υ(CO)消耗 | |
| C. | 达平衡过程体系能量的变化:Q1=4Q2 | |
| D. | 平衡时,①与②容器中CO的体积分数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有X、Y、Z、W、P、Q六种前两周期的主族元素,原子序数依次增大,价电子数之和为26,原子半径依Y、Z、W、P、Q、X依次减小.围绕上述元素,回答下列问题:
有X、Y、Z、W、P、Q六种前两周期的主族元素,原子序数依次增大,价电子数之和为26,原子半径依Y、Z、W、P、Q、X依次减小.围绕上述元素,回答下列问题: ,YQ3中心原子的杂化类型为sp2杂化,除X外,其余元素的第一电离能由小到大顺序为B<C<O<N<F(元素符号回答).
,YQ3中心原子的杂化类型为sp2杂化,除X外,其余元素的第一电离能由小到大顺序为B<C<O<N<F(元素符号回答).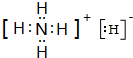 ,其与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.
,其与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;该微粒的表示符号为O2-.
;该微粒的表示符号为O2-.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com