
| 实验序号 | ① | ② | ③ |
| 加入试剂(取等体积溶液) | 0.01mol/LKMnO4 0.1mol/LH2C2O4 | 0.01mol/LKMnO4 0.1mol/LH2C2O4 MnSO4固体 | 0.01mol/LKMnO4 0.1mol/LH2C2O4 Na2SO4固体 |
| 褪色时间/s | 116 | 6 | 117 |
分析 (1)实验①、②、③中使用的反应物是都是 0.01 mol/L KMnO4、0.1 mol/LH2C2O4,都在室温下反应,说明浓度相同,温度相同,对比其他条件以及高锰酸钾褪色时间的快慢,从催化剂对化学反应速率的影响进行分析;
(2)从影响化学反应速率的外界因素温度、浓度等分析;
(3)根据草酸与酸性高锰酸钾反应生成了MnSO4来分析;
(4)根据酸性KMnO4溶液具有强氧化性,能氧化氯化锰中的氯离子,也会使KMnO4溶液褪色,产生干扰进行分析.
解答 解:(1)实验①、②、③中使用的反应物是都是 0.01 mol/L KMnO4、0.1 mol/LH2C2O4,都在室温下反应,说明浓度相同,温度相同,高锰酸钾褪色时间最快的是②,加了硫酸锰,③中加的是硫酸钠与①褪色时间基本相同,对比得知起催化作用的是Mn2+,
故答案为:在其他条件相同时,Mn2+是草酸与酸性高锰酸钾反应的催化剂,起着加快反应速率的作用;
(2)除催化剂对反应速率有影响外,还有其他的外界因素如温度、浓度等,
故答案为:温度、浓度等;
(3)实验②中是单独加入催化剂MnSO4,而草酸与酸性高锰酸钾反应本生是会生成MnSO4的,那么这个反应的产物就会起到催化剂的作用,所以实验①的现象是:KMnO4溶液褪色的速率开始十分缓慢,一段时间后突然加快,因为反应生成的MnSO4是草酸与酸性高锰酸钾反应的催化剂,能加快化学反应速,
故答案为:KMnO4溶液褪色的速率开始十分缓慢,一段时间后突然加快,因为反应生成的MnSO4是草酸与酸性高锰酸钾反应的催化剂,能加快化学反应速;
(4)酸性KMnO4溶液具有强氧化性,能氧化氯化锰中的氯离子,也会使KMnO4溶液褪色,从而缩短褪色时间,产生干扰,
故答案为:酸性KMnO4溶液具有强氧化性,能氧化氯化锰中的氯离子,也会使KMnO4溶液褪色,产生干扰.
点评 本题考查了草酸与酸性高锰酸钾溶液反应,探究影响化学反应速率的因素,注意对比实验的关键是其他条件不变,控制其中的一个变量进行分析,另外考查了酸性高锰酸钾溶液的强氧化性,题目难度适中.


科目:高中化学 来源: 题型:解答题
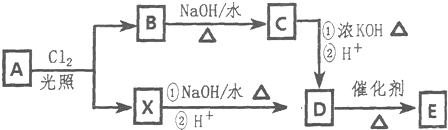
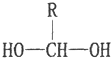 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$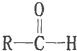

 +4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$
+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$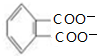 +2NH4++4Ag+6NH3+2H2O
+2NH4++4Ag+6NH3+2H2O .
. .
.
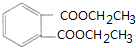 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(B2)=0.8mol(L•s)-1 | B. | v(A2)=0.4 mol(L•s)-1 | ||
| C. | v(C)=0.6 mol(L•s)-1 | D. | v(D)=0.1 mol(L•s)-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
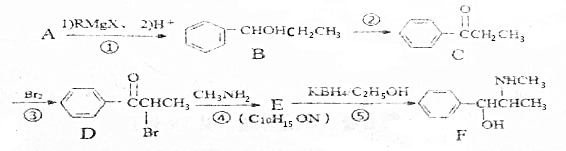
 (R、R′、R″均代表烃基;X代表卤素原子);
(R、R′、R″均代表烃基;X代表卤素原子); .
. .反应⑤的反应类型为还原反应.
.反应⑤的反应类型为还原反应. .
. (写反式结构)
(写反式结构)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
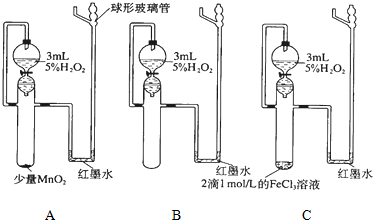
| 实验目的 | 催化剂对过氧化氢分解化学反应速率影响 | ||
| 实验步骤 | 在三个相同的带活塞的漏斗中分别加入2~3mL约5%的H2O2,然后在一支试管中滴加2滴1mol/L的FeCl3溶液,另一支试管中加入少量MnO2固体.同时向三支试管中放入漏斗中的全部溶液,观察红墨水上升情况. | ||
| 反应条件 | A少量MnO2 | B无催化剂 | C 2滴FeCl3溶液 |
| 实验现象 | |||
| 反应速 率大小 | (用v (A)、v (B)、v (C)表示) | ||
| 得出结论 | |||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,图为反应产生氢气速率与反应时间的关系图.
某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,图为反应产生氢气速率与反应时间的关系图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 装置 | 实验前的质量/g | 实验后的质量/g |
| F | 22.5 | 33.6 |
| H | 42.4 | 51.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
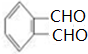
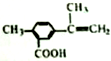 ,有关该化合物的叙述正确的是( )
,有关该化合物的叙述正确的是( )| A. | 该有机物属于芳香烃 | |
| B. | 仅考虑取代基在苯环上的位置变化,M的同分异构体有9种 | |
| C. | 该有机物的碳原子一定处于同一平面 | |
| D. | 该有机物一定条件下只能发生加成反应和酯化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com