
| 气体物质 | 主要来源 | 对环境的影响 | |
| A | 二氧化碳 | 化石燃料的燃烧 | 酸雨 |
| B | 二氧化氮 | 汽车尾气的排放 | 光化学烟雾 |
| C | 二氧化硫 | 工厂废气的排放 | 温室效应 |
| D | 一氧化碳 | 含酚醛树脂胶的人造板装饰材料 | 臭氧空洞 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二氧化碳易造成温室效应;
B.二氧化氮易形成光化学烟雾;
C.二氧化硫一形成酸雨,而温室效应的罪魁祸首为二氧化碳;
D.CO主要来自燃料的不充分燃烧,臭氧层空洞与臭氧有关.
解答 解:A.化石燃料燃烧会产生二氧化碳,但二氧化碳为温室效应的罪魁祸首,不会形成酸雨,故A错误;
B.汽车排放的尾气中含有二氧化氮,二氧化氮易形成光化学烟雾,故B正确;
C.工厂排放的废气中可能含有二氧化硫,二氧化硫易形成酸雨,温室效应的罪魁祸首为二氧化碳,故C错误;
D.含酚醛树脂胶的人造板装饰材料释放的是甲醛、苯有毒物质,不会释放CO,且臭氧空洞与臭氧有关,故D错误;
故选B.
点评 本题考查环境污染类型及成因,题目难度不大,明确常见污染物类型及治理措施为解答关键,试题有利于提高学生的分析能力及环保意识.


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:选择题
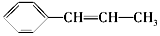 ,它可能具有的性质是( )
,它可能具有的性质是( )| A. | 不易溶于水,易溶于苯等有机溶剂 | B. | 是芳香烃,也是苯的同系物 | ||
| C. | 能发生聚合反应,其产物可表示为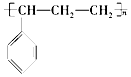 | D. | 分子中所有碳原子一定在同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
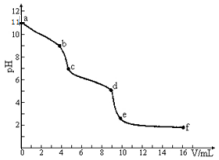 常温下饱和CO2溶液的pH约为5.6.向某未知浓度的Na2CO3溶液中滴入已知浓度的盐酸时,用 pH传感器测得混合溶液的pH变化曲线如图所示,下列说法正确的是( )
常温下饱和CO2溶液的pH约为5.6.向某未知浓度的Na2CO3溶液中滴入已知浓度的盐酸时,用 pH传感器测得混合溶液的pH变化曲线如图所示,下列说法正确的是( )| A. | 该Na2CO3溶液的浓度为0.001mol/L | |
| B. | 在pH=7时,c(Na+)>c(Cl-) | |
| C. | 在pH=6时,c(Na+)>c(CO32-)>c(HCO3-) | |
| D. | c→d发生的主要离子反应为:CO32-+H+=HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质(括号中为杂质) | 除杂试剂 | 操作 |
| A | 碳酸钡(硫酸钡) | 饱和碳酸钠溶液 | 搅拌、过滤 |
| B | CO2(HCl) | 饱和碳酸钠溶液 | 洗气 |
| C | FeCl3(FeCl2) | 足量铁粉 | 搅拌、过滤 |
| D | HCl(Cl2) | 饱和食盐水 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:
已知:
 .
.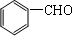 ;H的顺式结构简式为
;H的顺式结构简式为 .
. (任写一种).
(任写一种).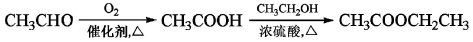
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuO+H2═Cu+H2O | B. | CuO+CO═CO2+Cu | ||
| C. | Fe+CuSO4═Cu+FeSO4 | D. | Cu2(OH)2CO3═2CuO+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加A物质的质量 | B. | 向容器中再充入B气体 | ||
| C. | 升高反应体系的温度 | D. | 从容器中移出部分C气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12 g金刚石含有的共价铤数目为2NA | |
| B. | 标准状况下,2.24L乙醇中碳氢键的数目为0.5Na | |
| C. | 1 mol NH3中含有3NA对共用电子对 | |
| D. | 常温常压下,8gO2含有4NA个质子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com