
【题目】阿伏加德罗常数的值为NA,下列说法中正确的是( )
A. 5NH4NO3 ![]() 2HNO3+4N2↑+9H2O反应中,生成28 g N2,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28 g N2,转移的电子数目为3.75NA
B. 常温常压下,ag某气体含分子数为b,则cg该气体的体积为![]()
C. 2mol/L的CaCl2溶液中Cl-的数目为4NA
D. 46g NO2和N2O4的混合气体中含有的氧原子个数为3NA
【答案】A
【解析】
A、反应中铵根离子中的氮从-3价升高到氮气中的+5价,每生成4mol氮气转移15mol电子,所以当有28g氮气生成时,转移电子为3.75mol,转移的电子数目为3.75NA,故A正确;
B、常温常压下,气体的摩尔体积不能用22.4L/mol故B错误;
C、2mol/L的CaCl2溶液中Cl-的浓度为2mol/L,题干中没有给出溶液体积,所以不能确定氯离子数目,故C错误;
D、NO2和N2O4的最简式都是NO2,所以只要把混合气体当作只含NO2看就可以了。46gNO2是1mol,一个NO2分子含2个氧原子,所以合气体中含有氧原子个数为2NA,故D错误;
综上所述,本题应选A。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.花生油的主要成分是高级脂肪酸甘油酯,属于高分子化合物
B.汽油和食用油都可以在碱性条件下水解
C.脱脂棉、滤纸的主要成分均为纤维素,完全水解能得到葡萄糖
D.钠与乙醇反应时钠浮在液面上,反应比钠与水反应更剧烈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石的主要成分为Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuCl2·3H2O及CaCO3的步骤如下:
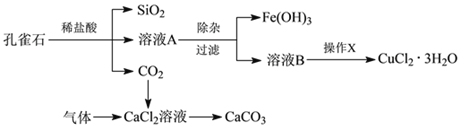
为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如下:
物质 | pH (开始沉淀) | pH(完全沉淀) |
Fe(OH)3 | 1.9 | 3.2 |
Fe(OH)2 | 7.0 | 9.0 |
Cu(OH)2 | 4.7 | 6.7 |
(1)在除杂过程时为了除去Fe2+,常加入绿色氧化剂,使Fe2+氧化为Fe3+,此过程涉及的离子方程式为________。
(2)然后再加入适当物质调节溶液的pH至_________ (填写范围),使Fe3+转化为Fe(OH)3,可以达到除去Fe3+,调整溶液pH不可选用下列中的________。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(3)检验Fe(OH)3是否沉淀完全的实验方案是________________________。
(4)操作X包括________、________、过滤和洗涤等。CuCl2·3H2O加热灼烧的最终产物的化学式是 ______________。
(5)某种胃药片的治酸剂为CaCO3,该药片中CaCO3质量分数的测定步骤如下:
a.配制0.1mol·L-1的HCl溶液和0.1mol·L-1的NaOH溶液各250mL。
b.取0.6g磨碎后的胃药于锥形瓶中。
c.向锥形瓶内加入25.00mL 0.1 mol·L-1的HCl溶液。
d.以酚酞为指示剂,用0.1mol·L-1的NaOH溶液滴定,至达到滴定终点。
e.重复bcd三步的操作2次。
①读数时,若滴定前平视,滴定后仰视,则所测CaCO3的质量分数将________(选填“偏大”、“偏小”或“无影响”)。
②若滴定中NaOH溶液的平均用量为15.00mL,则胃药中碳酸钙的质量分数为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1 mol·L1的盐酸滴定20 mL约0.1 mol·L1氨水,滴定曲线如图所示,下列说法正确的是
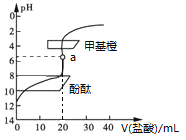
A. a点溶液中:c(H+)=c(OH)+c(NH3·H2O)
B. 滴定过程中,当溶液的pH=7时,两者恰好中和
C. 用酚酞作指示剂比用甲基橙作指示剂,滴定误差更小
D. 当滴入盐酸为30 mL时,溶液中:c(NH4+)+c(H+)<c(OH)+c(Cl)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组需要用 18 mol/L 的浓硫酸配制80mL 3.0 mol/L 稀硫酸的实验步骤如下: ① 计算所用浓硫酸的体积 ② 量取一定体积的浓硫酸 ③ 稀释 ④ 检漏、 转移、洗涤 ⑤ 定容、摇匀 回答下列问题:
(1)所需浓硫酸的体积是________mL, 量取浓硫酸所用的量筒的规格是_________(用下列编号填空) 。
A.10 mL B.25 mL C.50 mL D.100 mL
(2)第⑤步实验的操作是继续向容量瓶中注入蒸馏水至离刻度线__________, 改用___________向容量瓶中滴加蒸馏水至___________为止。塞紧瓶塞,倒转摇匀并装试剂瓶。
(3)下列情况对所配制的稀硫酸浓度有何影响? (填 “ 偏大 ”“ 偏小 ” 或 “ 无影响”)
①所用的浓硫酸长时间放置在密封不好的容器中 ______________;
②容量瓶用蒸馏水洗涤后残留有少量的水_________________;
③在转入容量瓶前烧杯中溶液未冷却至室温_________;
④取完浓硫酸后洗涤量筒,并把洗涤液倒入烧杯___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蓝色荧光材料D的合成路线如下:
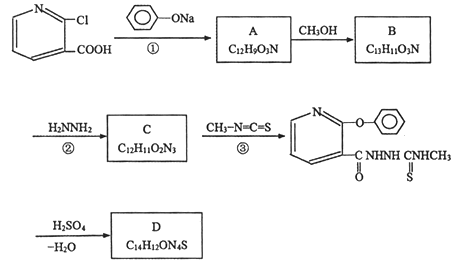
已知:
Ⅰ.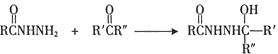
Ⅱ.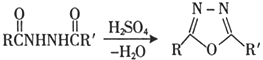
回答下列问题:
(1)①的反应类型为________。
(2)反应②的另一产物为甲醇,其化学方程式为________。
(3)下列说法正确的是________。
A.1molA最多能与7molH2加成 B.化合物B能与FeCl3溶液发生显色反应
C.化合物C具有碱性 D.化合物D的结构简式为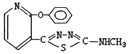
(4)写出同时符合下列条件的化合物![]() 的同分异构体结构简式________。
的同分异构体结构简式________。
①含苯环;②1H-NMR谱表明分子中有2种氢原子。
(5)设计以![]() 和
和![]() 为原料制备
为原料制备![]() 的合成路线(用流程图表示,无机试剂任选)________。
的合成路线(用流程图表示,无机试剂任选)________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com