
ĄūÓĆ“ß»ÆŃõ»Æ·“Ó¦½«SO2×Ŗ»ÆĪŖSO3ŹĒ¹¤ŅµÉĻÉś²śĮņĖįµÄ¹Ų¼ü²½Öč£®
ŅŃÖŖ£ŗSO2£Øg£©+1/2O2£Øg£©⇌SO3£Øg£©”÷H=﹣98kJ•mol﹣1£®
£Ø1£©Ä³ĪĀ¶ČĻĀøĆ·“Ó¦µÄĘ½ŗā³£ŹżK=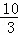 £¬ČōŌŚ“ĖĪĀ¶ČĻĀ£¬Ļņ100LµÄŗćČŻĆܱÕČŻĘ÷ÖŠ£¬³äČė3.0mol SO2£Øg£©”¢16.0mol O2£Øg£©ŗĶ3.0mol SO3£Øg£©£¬Ōņ·“Ó¦æŖŹ¼Ź±v£ØÕż£©””””v£ØÄę£©£ØĢī”°£¼”±”¢”°£¾”±»ņ”°=”±£©£®
£¬ČōŌŚ“ĖĪĀ¶ČĻĀ£¬Ļņ100LµÄŗćČŻĆܱÕČŻĘ÷ÖŠ£¬³äČė3.0mol SO2£Øg£©”¢16.0mol O2£Øg£©ŗĶ3.0mol SO3£Øg£©£¬Ōņ·“Ó¦æŖŹ¼Ź±v£ØÕż£©””””v£ØÄę£©£ØĢī”°£¼”±”¢”°£¾”±»ņ”°=”±£©£®
£Ø2£©Ņ»¶ØĪĀ¶ČĻĀ£¬ĻņŅ»“ų»īČūµÄĢå»żĪŖ2LµÄĆܱÕČŻĘ÷ÖŠ³äČė2.0mol SO2ŗĶ1.0mol O2£¬“ļµ½Ę½ŗāŗóĢå»ż±äĪŖ1.6L£¬ŌņSO2µÄĘ½ŗā×Ŗ»ÆĀŹĪŖ””””£®
£Ø3£©ŌŚ£Ø2£©ÖŠµÄ·“Ó¦“ļµ½Ę½ŗāŗó£¬øıäĻĀĮŠĢõ¼ž£¬ÄÜŹ¹SO2£Øg£©Ę½ŗāÅØ¶Č±ČŌĄ“¼õŠ”µÄŹĒ””””£ØĢī×ÖÄø£©£®
A£®±£³ÖĪĀ¶ČŗĶČŻĘ÷Ģå»ż²»±ä£¬³äČė1.0mol O2
B£®±£³ÖĪĀ¶ČŗĶČŻĘ÷ÄŚŃ¹Ēæ²»±ä£¬³äČė1.0mol SO3
C£®½µµĶĪĀ¶Č
D£®ŅĘ¶Æ»īČūŃ¹ĖõĘųĢå
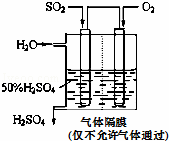
£Ø4£©ČōŅŌČēĶ¼ĖłŹ¾×°ÖĆ£¬ÓƵē»ÆѧŌĄķÉś²śĮņĖį£¬Š“³öĶØČėO2µē¼«µÄµē¼«·“Ó¦Ź½ĪŖ””””£®
£Ø5£©ĪŖĪČ¶Ø³ÖŠųÉś²ś£¬ĮņĖįČÜŅŗµÄÅضČÓ¦Ī¬³Ö²»±ä£¬ŌņĶØČėSO2ŗĶĖ®µÄÖŹĮæ±ČĪŖ””””£®
| »ÆŃ§Ę½ŗā½ØĮ¢µÄ¹ż³Ģ£»»ÆŃ§Ę½ŗāµÄÓ°ĻģŅņĖŲ£»»ÆŃ§Ę½ŗāµÄ¼ĘĖć£®. | |
| ×ØĢā£ŗ | »ÆŃ§Ę½ŗā×ØĢā£® |
| ·ÖĪö£ŗ | £Ø1£©øł¾ŻÅضČÉĢÓėĘ½ŗā³£ŹżµÄ“óŠ”ÅŠ¶Ļ·“Ó¦½ųŠŠµÄ·½Ļņ £Ø2£©ĻČøł¾ŻĘ½ŗā³£Źż¼ĘĖć³öc£ØSO2£©£¬ŌŁøł¾Ż×Ŗ»ÆĀŹ¹«Ź½Ēó³öSO2µÄ×Ŗ»ÆĀŹ£» £Ø3£©øł¾ŻÅØ¶Č”¢ĪĀ¶Č”¢Ń¹ĒæµČĶā½ēĢõ¼ž¶Ō»ÆŃ§Ę½ŗāµÄÓ°Ļģ£¬Ēó³öĘ½ŗāŅʶÆŗóc£ØSO2£©£¬ £Ø4£©ĶØČėO2µē¼«µÄµē¼«ŹĒÕż¼«·“Ó¦£¬ŃõĘųµĆµ½µē×ÓÉś³ÉĒāŃõøłĄė×Ó£¬ŌŚĖįŠŌČÜŅŗÖŠÉś³ÉĖ®£» £Ø5£©øł¾ŻSO2”¢O2ŗĶĖ®ŠĪ³ÉĮņĖįČÜŅŗµÄÅضČĪŖ50%£¬Ēó³öSO2ŗĶĖ®µÄÖŹĮæ±Č£® |
| ½ā“š£ŗ | ½ā£ŗ£Ø1£©ŅņĪŖÅضČÉĢQC= ¹Ź“š°øĪŖ£ŗ£¾£» £Ø2£©øł¾ŻVĒ°/Vŗó=nĒ°/nŗó æÉµĆ£¬ĻņŅ»“ų»īČūµÄĢå»żĪŖ2LµÄĆܱÕČŻĘ÷ÖŠ³äČė2.0mol SO2ŗĶ1.0mol O2£¬“ļµ½Ę½ŗāŗóĢå»ż±äĪŖ1.6L£¬nŗó=2.4mol SO2£Øg£©+O2£Øg£©⇌SO3£Øg£© æŖŹ¼£Ømol£© 2.0 1.0 0 ·“Ó¦£Ømol£© a a a Ę½ŗā£Ømol£© 2.0﹣a 1﹣a a Ōņ£ŗ£Ø2.0﹣a£©+£Ø1.0﹣a£©+a=2.4 a=1.2 ĖłŅŌSO2µÄ×Ŗ»ÆĀŹ¦Į= £Ø3£©A”¢±£³ÖĪĀ¶ČŗĶČŻĘ÷Ģå»ż²»±ä£¬O2µÄÅضČŌö“ó£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬SO2µÄÅØ¶Č¼õŠ”£¬ĖłŅŌAÕżČ·£» B”¢±£³ÖĪĀ¶ČŗĶČŻĘ÷ÄŚŃ¹Ēæ²»±ä£¬³äČė0.4mol SO3£¬ŠĀµÄĘ½ŗāÓėŌĘ½ŗāµČŠ§£¬SO2µÄÅØ¶Č²»±ä£¬ĖłŅŌB“ķĪó£» C”¢½µµĶĪĀ¶Č£¬Ę½ŗāĻņ·ÅČȵķ½ĻņŅĘ¶Æ£¬¶ųÕż·“Ó¦ĪŖ·ÅČČ£¬ĖłŅŌĘ½ŗāÕżĻņŅĘ¶Æ£¬SO2µÄÅØ¶Č¼õŠ”£¬ĖłŅŌCÕżČ·£» D”¢ŅĘ¶Æ»īČūŃ¹ĖõĘųĢ壬SO2µÄÅضČĖ²¼äŌö“ó£¬Ö®ŗóĘ½ŗāĻņĘųĢåĢå»ż¼õÉŁµÄ·½ĻņŅĘ¶Æ£¬¼“ĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬SO2µÄÅØ¶Č¼õŠ”£¬ŌŁ“Īµ½“ļĘ½ŗāŹ±SO2µÄÅضČČŌ±ČŌĄ““ó£¬ĖłŅŌD“ķĪó£® ¹Ź“š°øĪŖ£ŗA”¢C£» £Ø4£©ĶØČėO2µē¼«µÄµē¼«ŹĒÕż¼«·“Ó¦£¬ŃõĘųµĆµ½µē×ÓÉś³ÉĒāŃõøłĄė×Ó£¬ŌŚĖįŠŌČÜŅŗÖŠÉś³ÉĖ®£¬µē¼«·“Ó¦ĪŖ£ŗO2+4e﹣+4 H+=2H2O£» ¹Ź“š°øĪŖ£ŗO2+4e﹣+4 H+=2H2O£» £Ø5£©Éč£ŗSO2ŗĶĖ®µÄÖŹĮæ·Ö±šĪŖa”¢b SO2 +H2O⇌H2SO3 64 18 82 a 164 196
Ōņ£ŗĮņĖįČÜŅŗµÄÖŹĮæ°Ł·ÖŹżĪŖ ĖłŅŌa£ŗb=16£ŗ29£» ¹Ź“š°øĪŖ£ŗ16£ŗ29£® |
| µćĘĄ£ŗ | ±¾Ģāæ¼²éĮĖ»ÆŃ§Ę½ŗāµÄÓŠ¹ŲÖŖŹ¶£¬ČēĄūÓĆÅضČÉĢÅŠ¶Ļ»Æѧ·“Ó¦½ųŠŠµÄ·½Ļņ£¬×Ŗ»ÆĀŹµÄ¼ĘĖć”¢Ķā½ēĢõ¼ž¶Ō»ÆŃ§Ę½ŗāµÄÓ°ĻģŅŌ¼°ÓŠ¹Ų»Æѧ¼ĘĖć£¬ŹŌĢā½ĻĮé»ī£¬×ŪŗĻŠŌĒ棬ĢāÄæÄŃ¶Č½Ļ“ó£® |


 ÓĄĒ¬½ĢÓżŗ®¼Ł×÷ŅµæģĄÖ¼ŁĘŚŃÓ±ßČĖĆń³ö°ęÉēĻµĮŠ“š°ø
ÓĄĒ¬½ĢÓżŗ®¼Ł×÷ŅµæģĄÖ¼ŁĘŚŃÓ±ßČĖĆń³ö°ęÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
°“ĻĀĆęµÄŹµŃé¹ż³ĢĢīæÕ£ŗ
Ē³ĀĢÉ«FeBr2ČÜŅŗ »ĘÉ«ŅŗĢå
»ĘÉ«ŅŗĢå
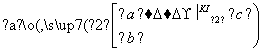
Š“³öÉĻŹö·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ
(1)_____________________________________________________________£¬
(2)______________________________________________________________ӣ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ÉčNA ĪŖ°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
A£®1 L 1 mol·L-1µÄNaClO ČÜŅŗÖŠŗ¬ÓŠClO£µÄŹżÄæĪŖNA
B£®78 g ±½ŗ¬ÓŠC=C Ė«¼üµÄŹżÄæĪŖ3NA
C£®³£ĪĀ³£Ń¹ĻĀ£¬14 g ÓÉN2ÓėCO×é³ÉµÄ»ģŗĻĘųĢåŗ¬ÓŠµÄŌ×ÓŹżÄæĪŖNA
D£® ±ź×¼×“æöĻĀ£¬6. 72 L NO2ÓėĖ®³ä·Ö·“Ó¦×ŖŅʵĵē×ÓŹżÄæĪŖ0. 1NA
±ź×¼×“æöĻĀ£¬6. 72 L NO2ÓėĖ®³ä·Ö·“Ó¦×ŖŅʵĵē×ÓŹżÄæĪŖ0. 1NA
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŅŌĻĀ½ųŠŠŠŌÖŹ±Č½ĻµÄŹµŃ飬²»ŗĻĄķµÄŹĒ£Ø””””£©
| ”” | A£® | ±Č½ĻCu”¢Fe2+µÄ»¹ŌŠŌ£ŗĢś¼ÓČėĮņĖįĶČÜŅŗÖŠ |
| ”” | B£® | ±Č½ĻĀČ”¢äåµ„ÖŹµÄŃõ»ÆŠŌ£ŗäå»ÆÄĘČÜŅŗÖŠĶØČėĀČĘų |
| ”” | C£® | ±Č½ĻĆ¾”¢ĀĮ½šŹōŠŌ£ŗĀČ»ÆĆ¾”¢ĀČ»ÆĀĮČÜŅŗÖŠ·Ö±š¼ÓČė¹żĮæµÄNaOHČÜŅŗ |
| ”” | D£® | ±Č½ĻĢ¼”¢Įņ·Ē½šŹōŠŌ£ŗ²ā¶ØĶ¬Ģõ¼žĶ¬ĪļÖŹµÄĮæÅØ¶ČµÄNa2CO3”¢Na2SO4ČÜŅŗµÄpH |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
³£ĪĀĻĀ£¬ÓĆNa2SO3ČÜŅŗĪüŹÕSO2Ź±£¬ČÜŅŗpHĖęn£Ø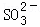 £©£ŗn£Ø
£©£ŗn£Ø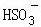 £© ±ä»ÆµÄ¹ŲĻµČē±ķ£ŗ
£© ±ä»ÆµÄ¹ŲĻµČē±ķ£ŗ
| n£Ø | 91£ŗ9 | 1£ŗ1 | 9£ŗ91 |
| pH | 8.2 | 7.2 | 6.2 |
ŅŌĻĀĄė×ÓÅØ¶Č¹ŲĻµµÄÅŠ¶ĻÕżČ·µÄŹĒ£Ø””””£©
| ”” | A£® | NaHSO3ČÜŅŗÖŠc£ØH+£©£¼c£ØOH﹣£© |
| ”” | B£® | Na2SO3ČÜŅŗÖŠc£ØNa+£©£¾c £ØSO32﹣£©£¾c£ØHSO3﹣£©£¾c£ØOH﹣£©£¾c£ØH+£© |
| ”” | C£® | µ±ĪüŹÕŅŗ³ŹÖŠŠŌŹ±£¬c£ØNa+£©£¾c£ØSO32﹣£©£¾c£ØHSO3﹣£©£¾c£ØOH﹣£©=c£ØH+£© |
| ”” | D£® | µ±ĪüŹÕŅŗ³ŹÖŠŠŌŹ±£¬c£ØNa+£©=c£ØHSO3﹣£©+2c£ØSO32﹣£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠŹĀŹµ¶ŌÓ¦µÄ»ÆѧÓĆÓļÕżČ·µÄŹĒ
A£®½šŹōÄĘ¼ÓČėµĪÓŠ·ÓĢŖµÄĖ®ÖŠ£¬ČÜŅŗ±äŗģ£ŗNa + 2H2O === Na+ + 2OH- + H2”ü
B£®ÓĆNaOHČÜŅŗĪüŹÕ¶ąÓąµÄĀČĘų£ŗCl2 + 2OH- === Cl- + ClO-+ H2O
C£®½«NaHCO3ČÜŅŗŗĶ¹żĮæCa(OH)2ČÜŅŗ»ģŗĻÓŠ°×É«³Įµķ£ŗ
2HCO3- + Ca2+ + 2OH- === CaCO3”ż + 2H2O + CO32-
D£®½«“×ĖįČÜŅŗµĪµ½“óĄķŹÆÉĻÓŠĘųÅŻ²śÉś£ŗ2H+ + CaCO3 === CO2”ü+ Ca2+ + H2O
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
¹¤ŅµÉĻ³£ÓĆĀČŃõ»Æ·Ø“¦Ąķŗ¬Ēč£ØCN-£©·ĻĖ®£¬Ņ»¶ØĢõ¼žĻĀ£¬ĀČĘųŗĶCN-·“Ӧɜ³ÉĪŽ¶¾ĘųĢ唣ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
A£®CN-ÖŠĢ¼ŌŖĖŲµÄ»ÆŗĻ¼ŪĪŖ+2
B£®øĆ·“Ó¦µÄ²śĪļÖ®Ņ»ŹĒĪŽ¶¾µÄN2
C£®µ±1 mol CN-²ĪÓė·“Ó¦Ź±£¬×ŖŅĘ3 mol e-
D£®“¦Ąķŗ¬0.1 mol CN-µÄ·ĻĖ®£¬ĄķĀŪÉĻŠčŅŖĻūŗıź×¼×“æöĻĀCl2µÄĢå»żĪŖ5.6 L
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
øł¾ŻŅŌĻĀ3øöČČ»Æѧ·½³ĢŹ½£ŗ
2H2S£Øg£©+3O2£Øg£©£½2SO2£Øg£©+2H2O£Øl£© ”÷H£½Q1 kJ/mol
2H2S£Øg£©+O2£Øg£©£½2S £Øs£©+2H2O£Øl£© ”÷H£½Q2 kJ/mol
2H2S£Øg£©+O2£Øg£©£½2S £Øs£©+2H2O£Øg£© ”÷H£½Q3 kJ/mol
ÅŠ¶ĻQ1”¢Q2”¢Q3ČżÕß¹ŲĻµÕżČ·µÄŹĒ
A£®Q1>Q2>Q3 B£®Q1>Q3>Q2 C£®Q3>Q2>Q1 D£®Q2>Q1>Q3
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
25 ”ꏱ£¬20.00 mLĮņĖįŗĶĻõĖįµÄ»ģŗĻČÜŅŗ£¬¼ÓČė×ćĮæµÄĀČ»Æ±µČÜŅŗ£¬³ä·Ö·“Ó¦ŗó¹żĀĖ”¢Ļ“µÓ”¢ŗęøÉ£¬æɵĆ0.466 g³Įµķ”£ĀĖŅŗøś2 mol/L NaOHČÜŅŗ·“Ó¦£¬ÓĆČ„10.00 mL¼īŅŗŹ±Ē”ŗĆÖŠŗĶ”£ĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ( ””)
A£®Ō»ģŗĻŅŗÖŠc(SO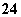 )£½0.2 mol/L B£®Ō»ģŗĻŅŗÖŠc(NO
)£½0.2 mol/L B£®Ō»ģŗĻŅŗÖŠc(NO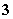 )£½0.9 mol/L
)£½0.9 mol/L
C£®Ō»ģŗĻŅŗÖŠpH£½0 D£®Ō»ģŗĻŅŗÖŠÓÉĖ®µēĄė³öµÄc(H£«)£½0.1 mol/L
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com