
| A、1s22s12p1表示的是激发态原子的电子排布 |
| B、元素的发射光谱一般是亮背景、暗线、线状不连续 |
| C、同一原子中,1s,2s,3s电子的能量逐渐减小 |
| D、各能层的能级都是从s能级开始至f能级结束 |


科目:高中化学 来源: 题型:
| A、气体中一定含有SO2,一定没有Cl2和H2S,可能含有HCl |
| B、气体中一定含有HCl和SO2,一定H2S,可能含有Cl2 |
| C、气体中一定含有SO2和Cl2,一定没有H2S,可能含有HCl |
| D、气体中一定含有SO2和Cl2,可能含有H2S和HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=a的氨水稀释10倍后,其pH=b,则a=b+1 |
| B、浓度相同的①NH4Cl ②CH3COONH4③NH4HSO4,三种溶液中的c(NH4+):①>③>② |
| C、将相同浓度的氨水与盐酸等体积混合,所得溶液中的离子浓度关系:c (NH4+)>c (Cl-)>c (H+)>c (OH-) |
| D、将a mol?L-1CH3COOH与b mol?L-1NaOH溶液等体积混合,测得溶液pH为7,则a与b的关系:a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:
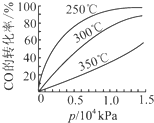 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.| 催化剂 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②>①>③ |
| B、③>①>② |
| C、③>②>① |
| D、①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 mol?L-1 |
| B、2.5 mol?L-1 |
| C、5 mol?L-1 |
| D、7.5 mol?L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4NO3、H2O、HNO3、N2 |
| B、HNO3、NH4NO3、H2O、N2 |
| C、H2O、HNO3、NH4NO3、N2 |
| D、H2O、NH4NO3、N2、HNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com