
【题目】草酸(HOOC-COOH)是一种常见的有机酸,利用淀粉制备草酸的实验流程如图:

回答下列问题:
(1)“水解”时,检验淀粉是否水解完全,所用的试剂是____;“水解”及“氧化”步骤中适宜的加热方式是________________。
(2)“氧化”时实验装置如图所示(夹持及加热装置已略):
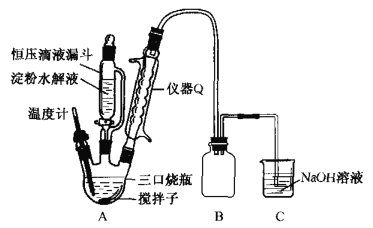
①仪器Q的名称是________.
②三口烧瓶中生成H2C2O4· 2H2O的化学方程式为____________。
③装置B的作用是___________,装置C的作用是_______________。
(3)已知在20℃、70℃时,草酸的溶解度依次为为9. 5 g/(l00g水),84.5g/(l00g水),则粗草酸“精制”需采用的提纯方法为___________________。
(4)探究H2C2O4的性质:
①向NaHCO3溶液中加入草酸溶液,产生大量气体,可得出草酸的酸性比碳酸_____(填“强”或“弱”)。
②向草酸中加入足量C2H5OH和适量浓硫酸加热,产生有芳香气味的油状物。该生成物为___________(写结构简式)。
③向K2Cr2O7溶液中加入H2C2 O4·2H2O析出K[Cr(C2O4)2(H2O)2]晶体,该反应的化学方程式为_____________________。
【答案】碘水 水浴加热 球形冷凝管 C6H12O6+12HNO3=3H2C2O4+9NO2↑+3NO↑+9H2O 做安全瓶,防止倒吸 吸收尾气中的NO和NO2,防止污染空气 重结晶 强 C2H5OOC-COOC2H5 K2Cr2O7+7H2C2O4·2H2O=2 K[Cr(C2O4)2(H2O)2]+6CO2↑+17H2O
【解析】
淀粉在稀硫酸催化下控制温度在70℃到80℃发生水解,得到葡萄糖,加入60%硝酸,在60℃下发生氧化,得到草酸,硝酸的还原产物有NO和NO2,草酸经结晶得到粗草酸,再经精制得到H2C2O4·2H2O。
(1)“水解”时,若淀粉水解完全,则不能使碘水变蓝;“水解”及“氧化”步骤中的温度都低于100℃,所以最适宜的加热方式是水浴加热。
(2)①仪器Q的名称是球形冷凝管,起冷凝回流易挥发的硝酸以及导出生成的NO和NO2的作用;
②在三口烧瓶中发生氧化反应,葡萄糖被氧化为H2C2O4· 2H2O,硝酸被还原为NO和NO2(体积比为1:3),根据电子守恒可以写出发生反应的化学方程式为C6H12O6+12HNO3=3H2C2O4+9NO2↑+3NO↑+9H2O;
③装置B是安全瓶,防止C中的NaOH溶液倒吸入三口烧瓶中,装置C的作用是吸收尾气,防止NO和NO2污染空气;
(3)草酸的溶解度随温度变化比较大,所以可以采用重结晶的方法精制粗草酸;
(4)①向NaHCO3溶液中加入草酸溶液,产生大量气体,说明草酸和NaHCO3溶液反应生成了二氧化碳,根据强酸制弱酸的规律,可得出草酸的酸性比碳酸强;
②向草酸中加入足量C2H5OH和适量浓硫酸加热,发生了酯化反应,产生有芳香气味的油状物草酸二乙酯,其结构简式为C2H5OOC-COOC2H5。
③向K2Cr2O7溶液中加入H2C2O4·2H2O析出K[Cr(C2O4)2(H2O)2]晶体,反应中Cr的化合价从+6价降低到K[Cr(C2O4)2(H2O)2]中的+3价,所以H2C2 O4·2H2O中的碳的化合价就会升高,从+3价升高到+4价,在K[Cr(C2O4)2(H2O)2]中还有+3价的碳,即反应物H2C2 O4·2H2O中的碳的化合价部分升高,部分没有变化,根据电子守恒和原子守恒可以写出该反应的化学方程式为K2Cr2O7+7H2C2O4·2H2O=2 K[Cr(C2O4)2(H2O)2]+6CO2↑+17H2O。


科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是![]()
A.![]() 溶液与
溶液与![]() 溶液混合后呈中性:
溶液混合后呈中性:![]()
B.![]()
![]() 溶液与过量NaOH溶液反应:
溶液与过量NaOH溶液反应:![]()
C.![]() 溶液中通入少量
溶液中通入少量![]() :
:![]()
D.![]() 溶液中加入过量的HI溶液:
溶液中加入过量的HI溶液:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是( )
A.HCO3-的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B.泡沫灭火器的原理:Al3++3HCO3-![]() Al(OH)3↓+3CO2↑
Al(OH)3↓+3CO2↑
C.NH4Cl溶于H2O中:NH4++H2O![]() NH3·H2O+OH-
NH3·H2O+OH-
D.Na2S显碱性原因:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾别名为红矾钾,室温下为橙红色晶体,溶于水,不溶于乙醇。它被国际癌症研究机构划归为第一类致癌物质,而且是强氧化剂,在实验室和工业中都有很广泛的应用。实验小组研究酸性条件下K2Cr2O7溶液和H2O2溶液的反应。相关资料如下:
序号 | 资料 |
① | Cr2(SO4)3溶液呈绿色 |
② | 酸性条件下,K2Cr2O7溶液和H2O2溶液反应生成CrO5,CrO5进一步反应生成Cr3+和O2 |
③ | CrO5可溶于水,易溶于乙醚得到蓝色溶液 |
④ | 乙醚是一种无色不溶于水,密度比水小的有机溶剂,化学性质稳定 |
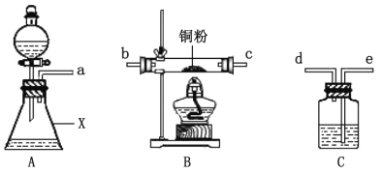
甲同学采用如图装置进行实验,探究了酸性条件下K2Cr2O7溶液和H2O2溶液的反应产物,实验步骤、操作等内容如下:
实验步骤 | 实验操作 | 实验现象 |
Ⅰ | 组装仪器 | —— |
Ⅱ | ? | —— |
Ⅲ | 向盛有H2O2溶液的仪器X中加入一定量的K2Cr2O7溶液和硫酸 | 溶液立即变为紫红色,此时pH=1,观察到溶液中持续产生气泡,最终溶液变为绿色 |
回答下列问题:
(1)用以上装置证明实验中产生的气体有氧气,装置的连接顺序是a→__→__→__→__。
(2)图中仪器X的名称是___。
(3)实验步骤Ⅱ是___。
(4)实验中紫红色溶液含有CrO5。
①验证紫红色溶液中含有CrO5的操作及现象是___。
②已知CrO5的结构式为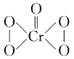 ,生成CrO5的反应,不是氧化还原反应,则该反应的离子方程式为___。
,生成CrO5的反应,不是氧化还原反应,则该反应的离子方程式为___。
(5)对上述实验中产生氧气、溶液变为绿色的原因,做出的假设①是CrO5在酸性溶液中不稳定,自身氧化还原生成Cr3+和O2。你还能做出的假设②是___。
(6)设计实验,选择合适的试剂,验证(5)中的假设①,你的设计是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀土是一种重要的战略资源。氟碳铈矿主要化学成分为CeFCO3,它是提取铈等稀土元素的重要矿物原料。氟碳铈矿的冶炼工艺流程如下:

已知:i.铈的常见化合价为+3、+4。焙烧后铈元素转化成CeO2和CeF4。四价铈不易进入溶液,而三价稀土元素易进入溶液。
ii.酸浸II中发生反应:9CeO2+3CeF4+45HCl+3H3BO3=Ce(BF4)3↓+11CeCl3+6Cl2↑+27H2O
请回答下列问题:
(1)①焙烧氟碳铈矿的目的是_______。
②焙烧后产生的CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2![]() CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:________。
CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:________。
(2)在酸浸I中用盐酸浸出时,有少量铈进入滤液,且产生黄绿色气体。少量铈进入稀土溶液发生反应的离子方程式是________。
(3)向Ce(BF4)3中加入KCl溶液的目的是______。
(4)操作I的名称为_______,在实验室中进行操作II时所需要的硅酸盐仪器有_______。
(5)“操作I”后,向溶液中加入NaOH溶液来调节溶液的pH,以获得Ce(OH)3沉淀,常温下加入NaOH调节溶液的pH应大于________即可认为Ce3+已完全沉淀。(已知:Ksp[Ce(OH)3]=1.0×10-20)
(6)取上述流程中得到的Ce(OH)4产品5.000g,加酸溶解后,向其中加入含0.03300mol FeSO4的FeSO4溶液使Ce4+全部被还原成Ce3+,再用0.1000mol·L-1的酸性KMnO4标准溶液滴定至终点时,消耗20.00mL标准溶液。则该产品中Ce(OH)4的质量分数为______(已知氧化性:Ce4+>KMnO4;Ce(OH)4的相对分子质量为208,保留3位有效数字)。
(7)在酸性条件下电解Ce2O3制备Ce(SO4)2(如下图),阳极电极反应式_______。
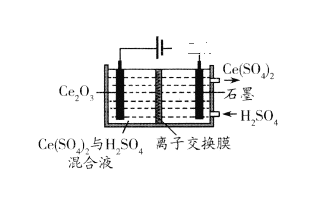
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A.10gH218O中所含的中子数为5NA
B.标准状况2.24L苯在O2中完全燃烧,得到0.6NA个CO2分子
C.常温下,pH=1的NH4NO3溶液,NO3-的数目为0.1NA
D.高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 表示阿伏加得罗常数,下列说法不正确的是
表示阿伏加得罗常数,下列说法不正确的是
A.对于![]() ,每当新形成
,每当新形成![]() 个
个![]() 键,需要断开
键,需要断开![]() 个
个![]() 键
键
B.![]() 熔融的
熔融的![]() 中含有的阳离子数为
中含有的阳离子数为![]()
C.次氯酸光照分解产生![]() 气体
气体![]() 标准状况
标准状况![]() 转移的电子数为
转移的电子数为![]()
D.电解精炼铜时,若阴极析出32g铜,则转移的电子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)常温下向一定体积的0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是___。
A.溶液中导电粒子的数目减少 B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中![]() 不变 D.溶液中
不变 D.溶液中![]() 减小
减小
(2)常温下将0.15mol/L稀硫酸V1mL与0.1mol/L NaOH溶液V2mL混合,所得溶液的pH为1,则V1:V2=___(溶液体积变化忽略不计)。
(3)常温下,某溶液中由水电离产生的c(H+)=1×10-11 mol·L-1,则该溶液的pH可能是___。
(4)常温下,在pH=9的CH3COONa溶液中,由水电离出的OH-浓度___。
(5)电解质水溶液中存在电离平衡、水解平衡,请回答下列问题。
已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①同浓度HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中碱性最强的是__;
②体积相同、c(H+)相同的三种酸溶液a.HCOOH;b.HCN;c.HCl分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母) __。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
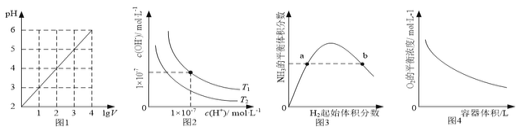
A. 图1表示1 L pH=2的CH3COOH溶液加水稀释至V L,pH随lg V的变化
B. 图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2>T1
C. 图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点
D. 图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s) ![]() 2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com