
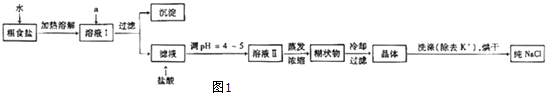
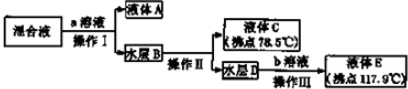
分析 (1)①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子,可以分别采用碳酸钠、氢氧化钠、氢氧化钠和氯化钡,根据试剂的添加原则来回答;
②根据有机物的性质以及氯化钾在有机物中的溶解度知识来回答;
(2)配制一定物质的量浓度的溶液,所需的仪器有:药匙、玻璃棒、天平、烧杯、500mL容量瓶、胶头滴管;
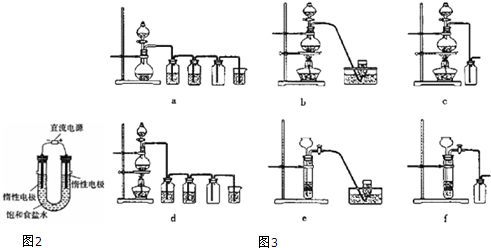
(3)根据电解饱和食盐水时的产物以及氯气和氢氧化钠的反应以及中和滴定实验原理知识来回答;
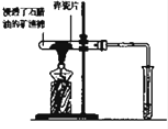
(4)实验室中采用金属锌和酸反应来获得氢气,利用二氧化锰和浓盐酸加热来获得氯气.
解答 解:(1)①要除去SO42-,只有选BaCl2溶液,若选用Ba(NO3)2,会引入新的离子NO3-,再选用NaOH溶液除去Mg2+和Fe3+溶液,最后选用Na2CO3溶液除去Ca2+,此处不能选用K2CO3溶液,否则会引入新的K+,再用HCl除去过量的CO32-,Na2CO3溶液不能加在BaCl2溶液前,否则会引入Ba2+,
故答案为:BaCl2、NaOH、Na2CO3;
②除去NaCl晶体表面的少量的KCl,应选用75%的乙醇,因为CCl4有毒,同时KCl也不会溶解在CCl4中,
故答案为:75%乙醇;
(2)配制一定物质的量浓度的溶液,所需的仪器有:药匙、玻璃棒、天平、烧杯、500mL容量瓶、胶头滴管,
故答案为:天平、烧杯、500mL容量瓶、胶头滴管;
(3)电解饱和食盐水的反应:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑,在阴级区内产生的Cl2能与该区生成的NaOH反应NaCl、NaClO和H2O,使得部分的Cl2被消耗,所以同样条件下收集到的Cl2小于2L,若测定溶液中NaOH的浓度,常用中和滴定的方法,
故答案为:<;电解生成的氯气与电解生成的NaOH发生了反应;中和滴定;
(4)实验室中采用金属锌和酸不加热反应来获得氢气,故选择装置e,利用二氧化锰和浓盐酸加热来获得氯气,其中的杂质氯化氢可以加饱和食盐水来除,杂质水可以采用浓硫酸来除去,可以选择装置d,
故答案为:e;d.
点评 本题主要考查了在粗盐提纯、配制一定物质的量浓度的溶液方法及常见气体的制备方法,题目难度中等,注意掌握粗盐提纯方法,明确除去杂质不要引入新的杂质,对于实验过程中过量的试剂都要除去.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:a>b>c | B. | 离子半径:Yn->Zm- | ||
| C. | a-b=m-n | D. | 原子核外最外层电子数:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨可用作制冷剂 | |
| B. | 硅酸钠用于制备硅胶和木材防火剂的原料 | |
| C. | 用热的纯碱溶液洗涤油污 | |
| D. | 明矾可用于自来水的杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| ① | 2 | 20 | |
| ② | 2 | 20 | 10滴饱和MnSO4溶液 |
| ③ | 2 | 30 | |
| ④ | 1 | 30 | 1mL蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 乙酸是白醋中的主要成分.
乙酸是白醋中的主要成分.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红色的溶液:Na+、Cu2+、HCO3-、NO3- | |
| B. | 0.1mol.L-1AgNO3溶液:H+、K+、SO42-、Cl- | |
| C. | 强酸性溶液:Mg2+、K+、SO42-、NO3- | |
| D. | 0.1mol.L-1NaAlO2溶液:NH4+、Na+、OH-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl难溶于水,悬浊液中不会溶有Ag+和Cl- | |
| B. | AgCl沉淀生成和AgCl沉淀溶解不断进行,但速率相等 | |
| C. | 在AgCl的悬浊液中加入AgCl固体,溶解的AgCl会增多 | |
| D. | 在AgCl的悬浊液中加入NaCl固体,AgCl沉淀的溶解度增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com