
现有苯甲酸、苯酚溶于乙醇所得的混合液,某同学设计方案分离三种物质,并检验其中的某些离子和物质。
已知:(1)酸性强弱:HCl>苯甲酸>H2CO3>苯酚> HCO3- (2)部分物理参数如下:
|
|
密度 (g·mL-1) |
熔点 (℃) |
沸点 (℃) |
溶解性 |
|
苯甲酸
|
1.2659 |
122.13℃ |
249℃ |
微溶于水,易溶于乙醇、乙醚等有机溶剂 |
|
苯酚
|
1.07
|
40.6
|
181.9
|
易溶于乙醇、乙醚,65℃以上能与水互溶 |
|
乙醇 |
0.79 |
-114.3 °C |
78.5 |
与水混溶,可混溶于醚、氯仿、甘油等多数有机溶剂 |
供选择试剂:10%氢氧化钠溶液、0.1mol/L盐酸、0.1mol/LNa2CO3、0.1mol/L NaHCO3、浓溴水、生石灰、0.1mol/L FeCl3、0.1mol/L BaCl2、CO2、0.1mol/L溴水、澄清石灰水
(1)分离物质流程如下:

①物质C是_____________,操作IV是_____________。
②操作III发生的主要化学反应方程式_________________ _______________________________。
③混合液2中加入生石灰的原因是_______。
(2)该同学检验混合液1中是否含有苯酚和NaHCO3,以证明酸性的强弱。
|
实验步骤 |
现象和结论 |
|
①取少量混合液1于试管,滴加________________________, 振荡,静置 |
|
|
②取少量步骤①上层清夜于试管,滴加__________________ ____________________________________________________ |
澄清石灰水变浑浊 说明混合液1含有HCO3- |
|
③另取少量混合液1于试管,滴加___________________,振荡 |
_________________________, 说明混合液1不含有酚羟基 |
(3)称取2.0g苯甲酸和苯酚的混合固体溶于足量乙醇中,滴加足量饱和NaHCO3溶液,测得放出的CO2(标准状况下,不考虑CO2溶于水)为33.6mL ,则苯甲酸的质量分数为_________________________(只列式,不计算),结果为________。(结果保留1位小数)(苯甲酸的相对分子质量为122,苯酚相对分子质量为94)
(17分)
①CO2 (2分) 过滤(2分)
②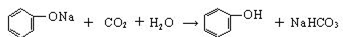 (2分)
(2分)
③生石灰与混合液2中的水反应,生成氢氧化钙溶液,便于乙醇从混合物中蒸馏出来(意思相同也得分)(2分)
(2)
|
实验步骤 |
现象和结论 |
|
①取一定量试样于试管,加入足量0.1mol/L BaCl2(1分), |
|
|
②取少量步骤①上层清夜于试管,滴加足量的 0.1mol/L盐酸, 再将产生的气体通入澄清石灰水中(2分) |
|
|
②另取少量试样于试管,滴加少量0.1mol/L FeCl3溶液(1分),(或者少量浓溴水),振荡 |
溶液不显紫色(或不出现白色的沉淀)(1分), |
(3)
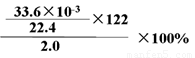 (2分) 9.2%(2分)
(2分) 9.2%(2分)
【解析】
试题分析:(1)①由于酸性强弱:HCl>苯甲酸>H2CO3>苯酚> HCO3-,则苯甲酸和苯酚的乙醇溶液与碳酸钠混合时,苯甲酸与碳酸钠反应,生成苯甲酸钠、二氧化碳和水,苯酚与碳酸钠反应生成苯酚钠和碳酸氢钠,而乙醇与碳酸钠都不反应;读图可得,混合液1的主要成分是苯甲酸钠、苯酚钠、碳酸氢钠、碳酸钠等物质,混合液2的主要成分是乙醇等物质;根据酸性强弱顺序,则物质C是碳酸或二氧化碳气体,苯酚钠与碳酸或二氧化碳和水发生复分解反应,生成苯酚、碳酸氢钠,而苯甲酸钠与碳酸或二氧化碳和水不反应,则混合液3的主要成分是苯甲酸钠和碳酸氢钠等物质;物质D是盐酸或HCl,盐酸与苯甲酸钠发生复分解反应,生成苯甲酸和氯化钠,盐酸与碳酸氢钠发生复分解反应,生成氯化钠、二氧化碳气体和水;由于苯甲酸微溶于水,则盐酸与苯甲酸钠反应容易形成苯甲酸的过饱和溶液时,可以析出苯甲酸晶体,从溶液中分离出苯甲酸晶体的操作IV是过滤;②略;③生石灰为氧化钙,CaO是碱性氧化物,容易与水反应,生成溶沸点较高的氢氧化钙,而乙醇与氧化钙不反应,且乙醇的溶沸点较低,蒸馏时乙醇容易从混合物中分离;(2)由于碳酸钠过量,则混合液1中可能含有苯甲酸钠、苯酚钠、碳酸氢钠、碳酸钠等物质,其中碳酸钠能干扰碳酸氢钠的检验,因此步骤①应先取样,再加入过量0.1mol/L BaCl2,振荡,静置,将碳酸根离子完全沉淀为碳酸钡,排除碳酸根离子对碳酸氢根离子的干扰;根据步骤②中现象和结论逆推,由于碳酸氢根离子在强酸作用下可以变为二氧化碳气体,说明向步骤①的上层清液中滴加足量0.1mol/L盐酸,再将产生的气体通入澄清石灰水中,澄清石灰水变浑浊,说明溶液1中含有碳酸氢根离子;由于步骤2中加入过量盐酸可以将苯酚钠转变为苯酚,因此步骤③需要另取混合液1,由于苯酚遇氯化铁溶液显紫色,苯酚钠遇氯化铁溶液不变色,苯酚遇浓溴水反应生成白色沉淀,苯酚钠遇浓溴水不能产生白色沉淀,因此向样品中加入0.1mol/L FeCl3或浓溴水,振荡,溶液不显紫色(或不出现白色的沉淀),说明混合液1不含有酚羟基或苯酚;(3)先求二氧化碳的物质的量(33.6×10-3/22.4mol),再根据苯甲酸与饱和碳酸氢钠溶液反应中苯甲酸与二氧化碳的系数之比等于物质的量之比求苯甲酸的物质的量(33.6×10-3/22.4mol),然后根据摩尔质量求苯甲酸的质量(33.6×10-3/22.4mol×122g/mol),最后根据混合固体的质量求苯甲酸的质量分数,即[33.6×10-3/22.4mol×122g/mol]÷2.0g×100%=9.15%≈9.2%。
考点:考查探究实验及化学计算,涉及分离流程图、复分解反应、除杂试剂的确定、混合物分离和提纯、分离提纯关键步骤的化学方程式、解释除杂试剂的作用、设计实验方案除去碳酸氢钠中混有的碳酸钠、设计实验方案检验碳酸氢钠的存在、设计实验方案检验苯酚是否存在、气体体积、气体摩尔体积、物质的量、物质的量在化学方程式中的应用、摩尔质量、苯甲酸的质量和纯度计算、有效数字的处理等。


科目:高中化学 来源: 题型:阅读理解
| 实验步骤 | 写出相应的离子方程式 |
| ①取试样加入足量10%的NaOH溶液,充分振荡后再将反应混合物倒入蒸馏烧瓶中蒸馏得到乙醇、水的混合物和产品A | 1OH-+C6H5-OH→C6H5O-+H2O OH-+C6H5-COOH→C6H5-COO-+H2O OH-+C6H5-COOH→C6H5-COO-+H2O |
| ②向步骤①的馏分中加入足量的生石灰,再次蒸馏浓缩,蒸气冷凝后得乙醇. | CaO+H2O=Ca(OH)2 |
| ③向产品A中通入足量CO2,静置后分液得 苯酚(C6H5-OH) 苯酚(C6H5-OH) 和溶液B. |
C6H5O-+CO2+H2O→C6H5OH+HCO3- C6H5O-+CO2+H2O→C6H5OH+HCO3- |
| ④再向溶液B中加入足量 盐酸 盐酸 、静置、过滤后可得苯甲酸. |
C6H5COO-+H+→C6H5COOH↓ C6H5COO-+H+→C6H5COOH↓ |

查看答案和解析>>
科目:高中化学 来源: 题型:
现有乙酸、苯、苯酚、苯甲酸四种有机物组成的混合物,可按右面的图示程序进行分离(已知苯甲酸是微溶于水的白色晶体)。
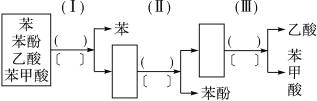
请在圆括号内填上适当的试剂名称,在方格号内填上分离操作的名称,在方框内填上适当物质的化学式。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲酸为不溶于水易溶于乙醇的无色晶体,苯酚常温下能溶于水,易溶于酒精。酸性强弱为:盐酸>苯甲酸>碳酸>苯酚>碳酸氢钠。现有苯甲酸、苯酚一起溶于乙醇所得的混合液,设计一个简单的实验方案,把这三种物质分离为各自的纯净物。按分离的先后顺序的多种可能方案:
方案一:按酸性由弱到强顺序分离
方案二:按酸性由强到弱顺序分离;
……
供选择试剂:①10%氢氧化钠溶液②37%盐酸③Na2CO3溶液④NaHCO3溶液⑤大理石⑥KMnO4溶液⑦生石灰⑧10%H2SO4
(1) 甲同学按实验方案一进行,请填写相关内容。
| 实验步骤 | 写出相应的离子方程式 |
| ①取试样加入足量10%的NaOH溶液 ,充分振荡后再将反应混合物倒入蒸馏烧瓶中蒸馏得到乙醇、水的混合物和产品A | ①OH-+C6H5-OH→C6H5O-+H2O ② |
| ②向步骤①的馏分中加入足量的生石灰,再次蒸馏浓缩,蒸气冷凝后得乙醇。 | CaO+H2O=Ca(OH)2 |
| ③向产品A中通入足量CO2,静置后分液得 和溶液B。 |
|
| ④再向溶液B中加入足量 、静置、过滤后可得苯甲酸。 |
|
(2)方案一中需要蒸馏操作,该操作需要的仪器除了铁架台、酒精灯、石棉网、接液管、锥形瓶和连接导管、橡胶塞外还要有 。
(3)方案一需要制取CO2应选用下述哪种装置 (填符号),该装置检验气密性的方法是 。
查看答案和解析>>
科目:高中化学 来源:2011届广东省中山市高三化学模拟试卷(十一) 题型:实验题
甲酸为不溶于水易溶于乙醇的无色晶体,苯酚常温下能溶于水,易溶于酒精。酸性强弱为:盐酸>苯甲酸>碳酸>苯酚>碳酸氢钠。现有苯甲酸、苯酚一起溶于乙醇所得的混合液,设计一个简单的实验方案,把这三种物质分离为各自的纯净物。按分离的先后顺序的多种可能方案:
方案一:按酸性由弱到强顺序分离
方案二:按酸性由强到弱顺序分离;
……
供选择试剂:①10%氢氧化钠溶液②37%盐酸③Na2CO3溶液④NaHCO3溶液⑤大理石⑥KMnO4溶液⑦生石灰⑧10%H2SO4
(1) 甲同学按实验方案一进行,请填写相关内容。
| 实验步骤 | 写出相应的离子方程式 |
| ①取试样加入足量10%的NaOH溶液,充分振荡后再将反应混合物倒入蒸馏烧瓶中蒸馏得到乙醇、水的混合物和产品A | ①OH-+C6H5-OH→C6H5O-+H2O ② |
| ②向步骤①的馏分中加入足量的生石灰,再次蒸馏浓缩,蒸气冷凝后得乙醇。 | CaO+H2O=Ca(OH)2 |
| ③向产品A中通入足量CO2,静置后分液得 和溶液B。 | |
| ④再向溶液B中加入足量 、静置、过滤后可得苯甲酸。 | |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com