
| A. | 该反应的△S>0 | |
| B. | 该反应的△H<0 | |
| C. | 该反应的逆反应在一定条件下也能自发进行 | |
| D. | 该反应的熵变效应大于焓变效应 |
分析 该反应是分解反应,且CO燃烧时放热,所以该反应为吸热反应,即△H>0,因气体的物质的量增多,所以△S>0.△G=△H-T△S<0时,反应可自发进行.
解答 解:该反应是分解反应,且CO燃烧时放热,所以该反应为吸热反应,即△H>0,因气体的物质的量增多,所以△S>0.△G=△H-T△S<0时,反应可自发进行,所以在低温下,该反应不能自发进行,
A.反应△S>0,故A正确;
B.分析可知反应△H>0,故B错误;
C.反应的逆反应为△H<0,△S<0的反应,当低温时△G=△H-T△S<0,反应可以自发进行,故C正确;
D.根据△G=△H-T•△S判断,反应能自发进行,必须满足△H-T•△S<0才可,即熵增大效应大于焓变效应.故D正确;
故选B.
点评 本题考查焓变和熵变,通过焓变和熵变综合判断化学反应的自发性,题目难度不大,注意反应能否自发进行,不取决于焓变或熵变中的一种,而是二者的综合判据,当△H-T•△S<0时,反应才能自发进行.


科目:高中化学 来源: 题型:选择题
| A. | 容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶都无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| B. | 铝丝先放在NaOH溶液中浸泡1min,取出用蒸馏水冲洗后放在浓硝酸中浸10min,最后放入CuSO4溶液中,铝丝表面无铜析出,说明Al常温下与CuSO4溶液不反应 | |
| C. | 用浓盐酸配制1:1(体积比)的稀盐酸(约6mol/L)通常需要用容量瓶等仪器 | |
| D. | 固体碘单质受热易升华,说明碘单质的热稳定性差 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl溶液中:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| B. | Na2SO4溶液中:c(Na+)+c(H+)=2c(SO42-)+c(OH-) | |
| C. | NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H+)>c(OH-) | |
| D. | 浓度均为0.1 mol/L的CH3COOH与CH3COONa溶液等体积混合所得溶液中:c (CH3COOH)+c(CH3COO-)=0.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实际应称Na2CO3质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器 |
| 2.7 | 250mL | 天平、烧杯、玻璃棒、胶头滴管、药匙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

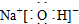 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-、Na+、OH-、K+ | B. | CO32-、Ba2+、K+、NO3- | ||
| C. | Ba2+、OH-、Cl-、Na+ | D. | CO32-、Na+、NO3-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有乙烷 | B. | 一定有丙烷 | ||
| C. | 可能是乙烷和丙烷的混合物 | D. | 可能是甲烷和丁烷的混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com