
分析 (1)工业上制粗硅为碳还原二氧化硅生成硅和一氧化碳;
(2)三大传统无机非金属材料是玻璃、陶瓷和水泥;
(3)向硅酸钠水溶液中通入少量二氧化碳发生反应生成碳酸钠和硅酸沉淀;
(4)①KBrO3在反应中得到电子,则Br元素的化合价降低,给出的物质中AsH3具有还原性,As元素的化合价在反应中升高;
②由元素化合价的变化来计算转移的电子;
③根据化合价的升降判断氧化剂和还原剂,根据得失电子守恒计算之比;
(5)容量瓶上需标有温度、规格和刻度线.
解答 解:(1)工业上制粗硅为碳还原二氧化硅生成硅和一氧化碳,发生化学方程式为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,故答案为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(2)三大传统无机非金属材料是玻璃、陶瓷和水泥,故答案为:玻璃、陶瓷和水泥;
(3)向硅酸钠水溶液中通入少量二氧化碳发生反应生成碳酸钠和硅酸沉淀,离子方程式为:H2O+CO2+SiO32-=CO32-+H2SiO3↓,
故答案为:H2O+CO2+SiO32-=CO32-+H2SiO3↓.
(4)①KBrO3在反应中得到电子,则Br元素的化合价降低,给出的物质中AsH3具有还原性,As元素的化合价在反应中升高,故答案为:AsH3;
②设X中Br元素化合价为x,由元素化合价的变化可知转移的电子为0.2mol×(5-x)=1mol,解得x=0,则X为Br2,故答案为:Br2;
③KBrO3在反应中生成Br2得到5个电子为氧化剂,AsH3在反应中生成H3AsO4失去8个电子为还原剂,转移的电子数为40e-,则根据得失电子相等,氧化剂与还原剂的物质的量之比为8:5,故答案为:8:5;
(5)容量瓶上需标有温度、规格和刻度线,故选:ACE.
点评 本题考查硅及其化合物的性质以及氧化还原反应,明确元素的化合价是解答本题的关键,注意利用氧化还原反应中的规律及表示方法来解答即可,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 漂白粉在空气中能稳定存在,可用于漂白纸张 | |
| B. | 氢氧化铝具有弱碱性,是医用中常见的胃酸中和剂 | |
| C. | 亚硝酸盐属于食物防腐剂,可以适量地添加于食物中 | |
| D. | 液氨气化时要吸收大量的热,使周围温度降低,因而液氨可作制冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 气体发生装置 | 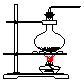 a | 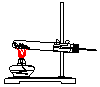 b |  c |
| 气体收集装置 |  2 |  ② |  ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过石油的裂解可以获得更多的汽油 | |
| B. | 蛋白质、纤维素、油脂、聚乙烯、淀粉都是高分子化合物 | |
| C. | 研制乙醇汽油(汽油中添加一定比例的乙醇)技术,可以降低机动车辆尾气中有害气体排放 | |
| D. | 石油、煤、天然气、植物油都属于化石燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,具有相同数目分子的气体必具有相同的体积 | |
| B. | 等质量的O2和H2的物质的量之比为16:1 | |
| C. | 不同的气体若体积不等,则它们所含的分子数一定不等 | |
| D. | 同温同体积下,两种气体的物质的量之比等于密度之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCN易溶于水 | |
| B. | 氢氰酸溶液可以使pH试纸变红 | |
| C. | NaCN溶液显碱性 | |
| D. | 等物质的量的HCN与NaOH恰好完全反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com