

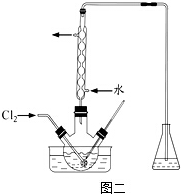


科目:高中化学 来源: 题型:
 室温下,在0.2mol?L-1 Al2(SO4)3溶液中,逐滴加入1.0mol?L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列有关说法正确的是( )
室温下,在0.2mol?L-1 Al2(SO4)3溶液中,逐滴加入1.0mol?L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列有关说法正确的是( )| A、a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3OH-?Al(OH)3 |
| B、a-b段,溶液pH增大,Al3+浓度不变 |
| C、b-c段,加入的OH-主要用于生成Al(OH)3沉淀 |
| D、d点时,Al(OH)3沉淀开始溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①③ | C、① | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
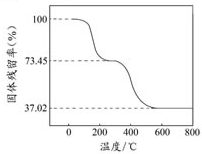 碱式碳酸铝镁[MgaAlb(OH)c(CO3)d?xH2O]常用作塑料阻燃剂.
碱式碳酸铝镁[MgaAlb(OH)c(CO3)d?xH2O]常用作塑料阻燃剂.| 固体样品的剩余质量 |
| 固体样品的起始质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 甲 | 乙 | 丙 | 丁 |
| 原子序数 | 6 | 8 | 11 | 13 |
| 元素符号 | ||||
| 周期 | ||||
| 族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com