
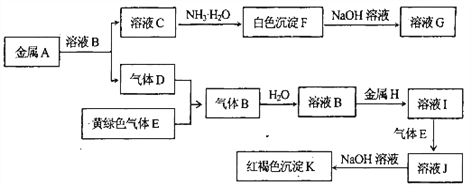
����Ŀ������A��B��C��D��E��F��G��H��I��J��K����ͼת����ϵ��D��EΪ���嵥�ʣ�����DΪ��������塣�Իش�
��1��д������K�Ļ�ѧʽ _______________��
��2��д��A��NaOH��Һ��Ӧ�Ļ�ѧ����ʽ��______________________________________��
��3��д����Ӧ��I��J�������ӷ���ʽ��____________________________________________��
��4������ҺI�е���NaOH��Һ���ɹ۲쵽�������ǣ�_______________________________��
��5����1 L 0.2mol/L��C��Һ�м���a ml 5mol/L��NaOH��Һ�õ���7.8g��������a=____mL��
���𰸡� Fe(OH)3 2Al+2NaOH+2H2O=2NaAlO2+3H2�� 2Fe2+��Cl2=2Fe3+ +2Cl- �ȳ��ְ�ɫ�������漴��ɻ���ɫ������ɺ��ɫ 60����140
��������D��EΪ���嵥�ʣ�����DΪ��������壬D��������E�ǻ���ɫ���壬E����������������������B���Ȼ��⣬����ˮ�õ����ᡣ���ɫ����K�����������������H������I���Ȼ���������������Ӧ����J���Ȼ�����C��Һ�백ˮ��Ӧ���ɰ�ɫ����F��F����������������Һ�У���F������������G��ƫ�����ƣ�����A��Al��C���Ȼ�������
��1������K�Ļ�ѧʽΪFe(OH)3����2������NaOH��Һ��Ӧ�Ļ�ѧ����ʽΪ2Al+2NaOH+2H2O=2NaAlO2+3H2������3����Ӧ��I��J�������ӷ���ʽΪ2Fe2+��Cl2=2Fe3++2Cl-����4�����Ȼ�������Һ�е���NaOH��Һ���ɹ۲쵽���������ȳ��ְ�ɫ�������漴��ɻ���ɫ������ɺ��ɫ����5��1 L 0.2mol/L��AlCl3��Һ���Ȼ��������ʵ�����0.2mol����AlԪ�ض�ת��Ϊ����������������������������������=0.2mol��78g/mol=15.6g��7.8g��˵�������������һΪ��������ȫ��ֻ��������������������һ�����Ϊ���������ܽ⣬��������������������������NaAlO2���������������ʵ�����7.8g��78g/mol=0.1mol��������㣬��Al3����3OH��===Al(OH)3����֪NaOH�����ʵ���Ϊ0.1mol��3=0.3mol������NaOH��Һ�����Ϊ0.3mol��5mol/L=0.06L=60mL���ڳ��������ܽ⣬��
Al3����3OH��===Al(OH)3��
0.2mol 0.6mol 0.6mol
�ܽ����������Ϊ0.2mol-0.1mol=0.1mol
Al(OH)3��OH��===AlO2����2H2O
0.1mol 0.1mol
�����ĵļ�����ʵ���Ϊ0.6mol+0.1mol=0.7mol������NaOH��Һ�����Ϊ0.7mol��5mol/L=0.14L=140mL��


 ������ĩ��ϰ��ѵ��ϵ�д�
������ĩ��ϰ��ѵ��ϵ�д� С��ʿ��ĩ����100��ϵ�д�
С��ʿ��ĩ����100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����SO2�ֱ�ͨ������4����Һ�У��й�˵������ȷ����( )
A. �Թ�a��ʵ�����֤��SO2���л�ԭ�� B. �Թ�b����Һ��ɫ��˵��SO2����Ư����
C. �Թ�c���ܲ�����ɫ������˵��SO2���������� D. �Թ�d���ܲ�����ɫ�������ó���������ϡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʻ�ѧ����й������ں��ǡ���ѧ�������ǵ�������ǵ�δ������
(1)�Ա���ù�����������������д�����������������̼��Ӧ�Ļ�ѧ����ʽ______��
(2)������С�մ���������ķ��ݼ���д��С�մ�����ˮ�ĵ��뷽��ʽ______��
(3)������ָpH<_____�Ľ�ˮ������ȼ�պ���ú������������ˮ���䵽���棬��ʱ��䳤��ˮ���Ի�����ǿ�����û�ѧ����ʽ������ԭ��_________����ú�м�������ʯ��ʯ,���Դ�����úȼ��ʱSO2���ŷţ�ͬʱ�õ�����ƣ�������Ӧ�Ļ�ѧ����ʽ__________��
(4)������������ĸ���ָ����Է�ӳ�����ؿ��������������������������ҹ����������������______(����ĸ)��
A.CO2 B.N2 C.NO2 D.O2
(5)���ӹ�ҵ����30%��FeCl3��Һ��ʴ���ھ�Ե���ϵ�ͭ��������ӡˢ��·�塣д��FeCl3��Һ�����ͭ������Ӧ�����ӷ���ʽ___________������ʢ���Ȼ�����Һ���ձ���ͬʱ�������ۺ�ͭ�ۣ���Ӧ���������н�������ܳ��ֵ���_______��
A.��ͭ���� B.������ͭ C.����ͭ���� D.����ͭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڱ��Ļ�ѧ���ʵ���������ȷ���ǣ�������
A.����ȡ����Ӧ
B.����ʹ���Ը��������Һ��ɫ
C.�ܷ����ӳɷ�Ӧʹ��ˮ��ɫ
D.��ȼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
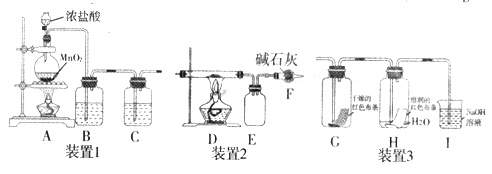
����Ŀ��������һ����Ҫ�Ļ���ԭ�ϣ������л����������з�Ӧ���ɶ����Ȼ��������ͼװ����ȡ����������һϵ�е�ʵ��̽����
�ش��������⣺
(1)װ��1�������Ʊ����������������:
��װ��A ��Բ����ƿ�ڷ�����Ӧ�����ӷ���ʽ��__________����Ӧ�б�������HCl �����ĵ�HCl���ʵ���֮��Ϊ_______��
��װ��B���Լ�Ϊ__________��װ��C��������_________��
(2)����װ��1��װ��2�����Ʊ������Ȼ�������(�Ȼ�������ˮ����300��ʱ����)����:
��D�з�����Ӧ�Ļ�ѧ����ʽΪ______________��
��D��E�䵼�ܶ��Ҵֵ�ԭ����______________��
������Dװ�õ�Ӳ�ʲ�������װ���������̼�ۣ��������·�Ӧ:
SiO2+2C+2Cl2![]() SiCl4+2CO
SiCl4+2CO
����Ӧ����6g̼ʱ,��Ӧת�Ƶĵ�����Ϊ______��Fװ��֮��Ӧ����һ��װ������_______��
(3)��װ��1��װ��3������̽�������Ƿ����Ư���ԡ�
�ٽ���������ͨ��ʢ�и����ɫ�����Ĺ��ƿ��ʢ��ʪ���ɫ�����Ĺ��ƿ���ɹ۲쵽��������________________��
��Ϊ��ֹ����β����Ⱦ������������ˮ�����Ե����ʣ���������������Һ���ն����������ԭ����(�����ӷ���ʽ��ʾ___________��������һԭ������ҵ�ϳ������۵�ʯ�������չ�ҵ����β���Ƶ�Ư�ۣ�Ư�۵���Ч�ɷ���_________(�ѧʽ)������¶���ڿ����е�ʧЧƯ�ۣ���ϡ����������������________(����ĸ������)��
A.O2 B.H2 C.CO2 D.HClO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������仯��������Ҫ�ĺϽ���Ϻʹ������䴢��Ͻ����Ϊһ������п���ӵ�صĸ������ϣ��õ����Zn(CF3SO3)2Ϊ����ʣ�����ȱ�ݵ���������ZnMn2O4Ϊ�缫���ɹ�������ȶ��Ĵ��ʵ�����
��1����̬��ԭ�ӵļ۵����Ų�ʽΪ_______�����Ų�ʱ������ߵĵ�����ռ���ܼ���ԭ�ӹ����_______����չ����
��2��VO2+�� �������
���γ����� �У����ַǽ���Ԫ�صĵ縺���ɴ�С��˳��Ϊ_______ (��Ԫ�ط��ű�ʾ)��
�У����ַǽ���Ԫ�صĵ縺���ɴ�С��˳��Ϊ_______ (��Ԫ�ط��ű�ʾ)��
��3�����γɵ�������[Ni(NH3)6]2+��[Ni(CN)4]2-��,NH3���ӵĿռ乹��Ϊ_______����CN-��Ϊ�ȵ������һ�ַ��ӵĻ�ѧʽΪ________ ��
��4����������(CF3SO3H)��һ���л�ǿ��,�ṹʽ��ͼ1��ʾ,ͨ����CS2��IF5��H2O2��Ϊ��Ҫԭ������ȡ��
��H2O2������Oԭ�ӵ��ӻ���ʽΪ_______��
��������������ⱽ��Ӧ�����������ᱽ���͵⻯�⡣1���������ᱽ�������к�����������ĿΪ_______��
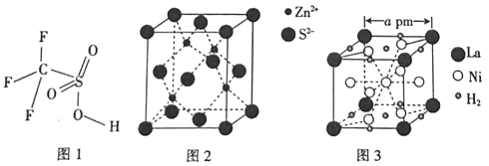
��5����п����Ĺ����ж���,����һ����п�ľ�����ͼ2��ʾ���þ�����S2-����λ��Ϊ_________��
��6�������Ͻ�����Ҫ�Ĵ������,�䴢���ľ�����ͼ3��ʾ��
�ٴ���ǰ�������Ͻ�Ļ�ѧʽΪ_________��
�ڸ������Ͻ��������ܶ�Ϊ_________(��NA��ʾ�����ӵ���������ֵ)g/cm3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ������O2��O3��һ��������ͬ��
A. ������ B. ���ʵ��� C. ��ԭ���� D. ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�����ʽ������ǣ� ��
A.Fe�Ļ�̬ԭ����Χ�����Ų�ͼ�� ![]()
B.�Ȼ��Ƶķ���ʽ��NaCl
C.N�Ļ�̬ԭ�Ӻ�������Ų�ʽ��1S22S22p3
D.HC1O�Ľṹʽ��H��O��Cl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��֤±�ص��������Ե����ǿ����ijС������ͼ��ʾװ�ý���ʵ�飨�г���������ȥ���������Ѽ��飩��
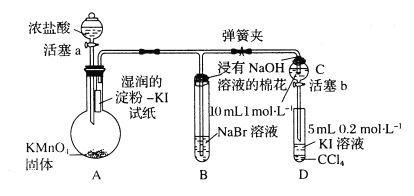
ʵ����̣�
I�����ɼУ�����a���μ�Ũ���ᡣ
II����B��C�е���Һ����Ϊ��ɫʱ���н����ɼС�
III.��B����Һ�ɻ�ɫ��Ϊ����ɫʱ���رջ���a��
IV������
(1)A�в�������ɫ����Ļ�ѧ��Ӧ����ʽ��___________��
(2)��֤������������ǿ�ڵ��ʵ��������___________��
(3)B����Һ������Ӧ�����ӷ���ʽ��___________��
(4)Ϊ��֤���������ǿ�ڵ⣬���̢��IJ�����___________��������___________��
(5)����IIIʵ���Ŀ����___________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com