
| A. | 被氧化和被还原的元素分别为铜和氮 | |
| B. | 当产生0.2mol气体时,转移电子为0.6mol | |
| C. | 被还原的CuO占参与反应CuO的$\frac{1}{2}$ | |
| D. | 参加反应的氧化剂和还原剂的物质的量之比为3:2 |
分析 CuO中的Cu元素由+2价降低为0,NH4Cl中的N元素的化合价由-3价升高为0,由电子守恒、原子守恒可知,NH4Cl失去3个电子,而铜得到2个电子,得失电子守恒,NH4Cl前面系数为2,铜前面的系数为3,再结合原子守恒配平可得4CuO+2NH4Cl=3Cu+CuCl2+N2+4H2O,据此对各选项进行判断.
解答 解:Cu由+2价降低为0,N元素的化合价由-3价升高为0,由电子守恒、原子守恒可知,NH4Cl失去3个电子,而铜得到2个电子,得失电子守恒,NH4Cl前面系数为2,铜前面的系数为3,再结合原子守恒配平可得:4CuO+2NH4Cl=3Cu+CuCl2+N2+4H2O,
A.氯化铵中N原子化合价升高被氧化,氧化铜中铜元素化合价降低被还原,则被氧化和被还原的元素分别为N和Cu,故A错误;
B.由反应可知,生成1mol气体转移6mol电子,则产生0.2mol的气体转移的电子为0.2mol×6=1.2mol,故B错误;
C.配平的反应为4CuO+2NH4Cl=3Cu+CuCl2+N2+4H2O,被还原的氧化铜占参加反应的氧化铜的$\frac{3}{4}$,故C错误;
D.根据反应4CuO+2NH4Cl=3Cu+CuCl2+N2+4H2O可知,参加反应的氧化剂为氧化铜,还原剂为氯化铵,二者的物质的量之比为3:2,故D正确;
故选D.
点评 本题考查氧化还原反应,为高频考点,题目难度中等,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查.


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:解答题
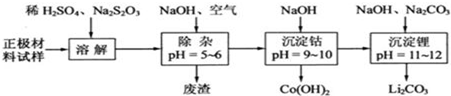
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:A2->D->B+ | |
| B. | 元素B、C的最高价氧化物对应水化物的碱性:B>C | |
| C. | 简单氢化物的稳定性:A>D | |
| D. | A与B形成的化合物中可能既有离子键又有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,14g CO所含质子数为7NA | |
| B. | 22g某气体含分子数为0.5NA,则其摩尔质量为44 | |
| C. | 标准状况下,33.6LCH4中含H原子数为6NA | |
| D. | 1 mol Na 完全反应时,失去NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 难溶于水的BaCO3是弱电解质 | |
| B. | 0.1mol/L的CH3COOH溶液中H+浓度为0.1mol/L | |
| C. | 强电解质水溶液的导电能力一定比弱电解质的强 | |
| D. | 电解质溶液导电的原因是溶液中有自由移动的阴、阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应中,反应物总能量与生成物总能量 | |
| B. | 化学反应中,反应物总质量与生成物总质量 | |
| C. | 溶液中,稀释前溶质质量与稀释后溶质质量 | |
| D. | 在化合物中,正化合价总数与负化合价总数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com