
| A. | 分子式为C3H6有机物最多存在3个C-C单键,与C4H10的碳碳单键数相同 | |
| B. | 乙烯、聚氯乙烯和苯分子中均含有碳碳双健 | |
| C. | 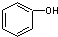 和 C7H8O分子组成相差一个-CH2-,因此是同系物关系 和 C7H8O分子组成相差一个-CH2-,因此是同系物关系 | |
| D. | 分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此可以确定有机物结构简式为C2H5-OH |
分析 A.分子式为C3H6有机物中,环丙烷分子中含有的碳碳键最多,含有3个碳碳键;分子式为C4H10的有机物为丁烷,分子中也含有3个碳碳键;
B.聚乙烯和苯分子中不含碳碳双键;
C. 为苯酚,属于酚类,而 C7H8O
为苯酚,属于酚类,而 C7H8O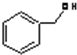 为苯甲醇,二者结构不同,一定不属于同系物;
为苯甲醇,二者结构不同,一定不属于同系物;
D.乙醇和二甲醚中都含有有C-H键和C-O键,无法根据红外光谱图上发现有C-H键和C-O键的振动吸收确定C2H6O的结构简式.
解答 解:A.分子式为C3H6有机物中,含有碳碳键最多的为环丙烷,环丙烷中含3个C-C单键,分子式为C4H10的有机物为丁烷,丁烷分子中也含有3个碳碳键,所以二者含有的碳碳单键数相同,故A正确;
B.聚乙烯和苯分子中不含碳碳双键,故B错误;
C. 含有酚羟基,为苯酚,属于酚类,而 C7H8O为
含有酚羟基,为苯酚,属于酚类,而 C7H8O为 含有醇羟基,为苯甲醇,属于醇类,二者结构不同,所以二者一定不属于同系物,故C错误;
含有醇羟基,为苯甲醇,属于醇类,二者结构不同,所以二者一定不属于同系物,故C错误;
D.乙醇(C2H5-OH)和二甲醚(CH3-O-CH3)分子中都存在C-H键和C-O键,所以无法根据红外光谱图上发现有C-H键和C-O键的振动吸收,判断该有机物的结构简式,故D错误;
故选A.
点评 本题考查了有机物结构与性质、同系物的判断,题目难度不大,注意掌握常见有机物结构与性质,明确同系物的概念及正确的判断方法.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x)kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y)kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y)kJ•mol-1 | |
| D. | 2CO2(g)+2NaOH(l)═2NaHCO3(l)△H=-(8x-2y)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向50mL 1mol•L-1明矾溶液中滴入少量0.1mol•L-1Ba(OH)2溶液Al3++2SO42-+2Ba2++3OH-═Al(OH)3↓+2BaSO4↓ | |
| B. | 已知还原性Fe2+>Br-,a mol FeBr2溶液中通入a mol Cl2:2Fe2++2Br-+2Cl2═Br2+2Fe3++4Cl- | |
| C. | 向KI与稀硫酸的混合溶液中通入氧气:4H++O2+6I-═3I2+2H2O | |
| D. | 在澄清石灰水中加入适量碳酸氢镁溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3=Na++HCO3- | B. | H2SO4?2H++SO42- | ||
| C. | NaHSO3=Na++H++SO32- | D. | 熔融状态下:NaHSO4=Na++H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、W、R是元素周期表前四周期元素中的五种常见元素,其原子序数依次增大.X的基态原子的最外层电子排布式为nsnnpn+1.Y、Z同主族且ZY2是导致酸雨的主要物质之一.R位于ds区且原子最外层只有一个电子.W原子次外层电子数为最外层电子数的7倍.请回答下列问题:
X、Y、Z、W、R是元素周期表前四周期元素中的五种常见元素,其原子序数依次增大.X的基态原子的最外层电子排布式为nsnnpn+1.Y、Z同主族且ZY2是导致酸雨的主要物质之一.R位于ds区且原子最外层只有一个电子.W原子次外层电子数为最外层电子数的7倍.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将标准状况下的2.24L CO2通入150mL 1mol•L-1 NaOH溶液中,所得溶液中c(CO32-)>c(HCO3-) | |
| B. | 常温下0.1 mol•L-1的下列溶液①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③ | |
| C. | 0.1 mol•L-1 pH为9的NaHB溶液中:c(HB-)>c(B2-)>c(H2B) | |
| D. | 室温下,将0.4mol/L HA溶液和0.2mol/LNaOH溶液等体积混合(忽略混合时溶液体积的变化)测得混合液pH=5,则c(A-)+c (OH-)>c(H+)+c(HA) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com