
在10mL硫酸和硫酸钾的混合溶液中,硫酸的物质的量浓度为1.6mol/L,硫酸钾的物质的量浓度为3.0mol/L.欲使硫酸的浓度变为2.0mol/L,硫酸钾的浓度变为0.30mol/L,现用98%的浓硫酸(ρ=1.84g·cm—3)和蒸馏水进行配制.试求需要取用浓硫酸的体积.
科目:高中化学 来源: 题型:阅读理解

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:辽宁省鞍山13中学2007届高三化学第二次模拟考试卷、新课标人教版 人教版新课标 题型:038
在10mL硫酸和硫酸钾的混合溶液中,硫酸的物质的量浓度为1.6mol/L,硫酸钾的物质的量浓度为3.0mol/L.欲使硫酸的浓度变为2.0mol/L,硫酸钾的浓度变为0.30mol/L,现用98%的浓硫酸(ρ=1.84g·cm—3)和蒸馏水进行配制.试求需要取用浓硫酸的体积.
查看答案和解析>>
科目:高中化学 来源:2009年安徽省合肥一中高考化学冲刺最后一卷(解析版) 题型:填空题
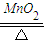 2KCl+3O2↑,2KMnO4
2KCl+3O2↑,2KMnO4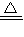 K2MnO4+MnO2+O2↑)
K2MnO4+MnO2+O2↑)| 加入药品 | 不加MnSO4的硫酸 酸化的H2C2O4溶液 | 加少量MnSO4的硫酸 酸化的H2C2O4溶液 |
| 实验现象 (褪色时间)/s | H2C2O4褪色很慢 (31秒) | H2C2O4褪色很快(4秒) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com