
科学家把药物连在高分子载体E上制成缓释长效药剂。阿司匹林
(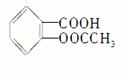 )可连接在某高分子聚合物上,形成缓释长效药剂,其中一种结构简式为:
)可连接在某高分子聚合物上,形成缓释长效药剂,其中一种结构简式为:
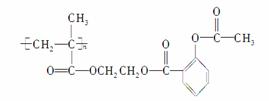
试回答下列问题:
(1)载体结构简式为________________________________。
(2)缓释反应的化学方程式为
________________________________________________________________________
________________________________________________________________________。
(3)阿司匹林在碱性条件下(NaOH)发生水解反应的化学方程式为
________________________________________________________________________
________________________________________________________________________。
(4)这种高分子载体是由单体发生聚合反应得到的,写出单体的结构简式:
________________________________________________________________________
________________________________________________________________________。
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
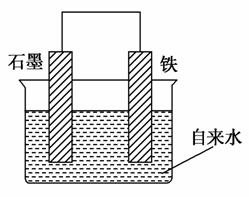
为探究钢铁的吸氧腐蚀原理设计了如图所示装置,下列有关说法中错误的是( )
A.正极的电极方程式为O2+2H2O+4e-===4OH-
B.将石墨电极改成Mg电极,难以观察到铁锈生成
C.若向自来水中加入少量NaCl(s),可较快地看到铁锈
D.分别向铁、石墨电极附近吹入O2,前者铁锈出现得快
查看答案和解析>>
科目:高中化学 来源: 题型:
消毒剂在生产生活中有极其重要的作用,开发具有广谱、高效、低毒的杀菌剂和消毒剂是今后发展的趋势。
(1)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是________ (填序号)。
A.Cl2 B.H2O2
C.ClO2 D.O3
(2)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称。如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O+H2O2===A+NH3↑,则生成物A的化学式为________,H2O2被称为“绿色氧化剂”的理由是_________________________________________。
(3)漂白剂亚氯酸钠(NaClO2)在常温下、黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为HClO2―→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时转移的电子数约为________。
(4)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是__________________________________(用离子方程式表示)。利用氯碱工业的产物可以生产“84”消毒液,写出有关反应的化学方程式:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于营养物质的说法正确的是( )
A.油脂的氢化属于还原反应,又属于加成反应,生成物为纯净物
B.1 mol蔗糖的水解产物是1 mol葡萄糖和 1 mol 果糖
C.淀粉溶液和稀硫酸共热后发生水解反应,冷却后加少量银氨溶液,水浴加热后出现光亮的银镜
D.鸡蛋白溶液中滴加饱和的硫酸铵溶液,出现白色沉淀,该过程叫做蛋白质的变性
查看答案和解析>>
科目:高中化学 来源: 题型:
有一种二肽的化学式是C8H14N2O5,发生水解反应后得到α氨基丙酸和另一种氨基酸X。X的化学式为( )
A.C4H7NO4 B.C6H7NO3
C.C5H9NO4 D.C5H11NO5
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于油、脂、矿物油的说法中,不正确的是( )
A.油是不饱和高级脂肪酸的单甘油酯,是纯净物
B.脂是高级脂肪酸中含饱和烃基较多的混甘油酸,脂属于酯类
C.油和脂是由于含饱和烃基和不饱和烃基的相对含量不同引起熔点不同进行区分的
D.区分植物油和矿物油可采用加入NaOH溶液加热的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)Ni(CO)4(g),已知该反应的平衡常数与温度的关系如下表:
| 温度/℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法不正确的是 ( )。
A.上述生成Ni(CO)4的反应为放热反应
B.25 ℃时反应Ni(CO)4(g)Ni(s)+4CO(g)的平衡常数为2×10-5
C.在80 ℃时,测得某时刻Ni(CO)4、CO的浓度均为0.5 mol·L-1,则此时
v正>v逆
D.80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol
·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
人类研究氢能源从未间断过,而热化学循环分解水制 H2是在水反应体系中加入一种中间物,经历不同的反应阶段,最终将水分解为H2 和 O2 ,这是一种节约能源、节省反应物料的技术,下图是热化学循环制氢气的流程:

(1)实验测得,1 g H2 燃烧生成液态水放出 142.9 kJ 的热量,则表示氢气燃烧的热化学方程式为_______________________________________________
______________________________________________________________。
(2)整个流程参与循环的物质是________和________(填化学式),最难进行的反应是________(填序号)。
(3)汞虽然有毒,但用途广泛。用汞和溴化钙作催化剂,可以在较低温度下经过下列反应使水分解制氢气和氧气:
①CaBr2 + 2H2O===Ca(OH)2 + 2HBr↑;
②……
③HgBr2 + Ca(OH)2===CaBr2 + HgO+H2O;
④2HgO===2Hg + O2↑。
反应②的化学方程式为___________________________________________。
(4)合成氨用的 H2 可以甲烷为原料制得。有关化学反应的能量变化如下图所示,则 CH4 (g)与 H2O(g)反应生成CO(g)和 H2 (g)的热化学方程式为_________________________________________________________。
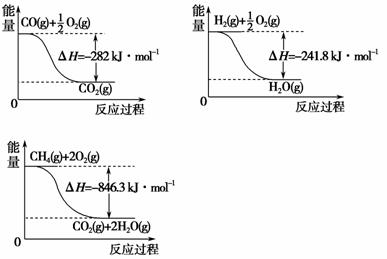
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com